一、判断氧化还原反应自发进行的方向
电池反应都是自发进行的氧化还原反应。因此电池反应的方向即氧化还原反应自发进行的方向。判断氧化还原反应进行的方向时,可将反应拆为两个半反应,求出电极电位。然后根据电位高的为正极起还原反应,电位低的为负极起氧化反应的原则,就可以确定反应自发进行的方向。如果两个电对的

值相差较大(即Eφ),浓度的变化对电位的影响不大,不致于使反应改变方向。因此,当Eφ<0.2V 时,即使不处于标准状态,也可直接用

值的大小确定反应方向。否则,必须考虑浓度和酸度的影响,用能斯特方程式计算出电对的

值,用E>0作为判断确定反应进行的方向,若E>0,正向反应能自发进行;E<0,正向反应不能自发进行,其逆向反应能自发进行。
例9 判断298K时下列反应进行的方向:
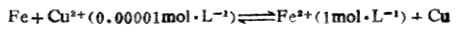
解:将上述反应写成两个半反应,并查出它们的标准电极是位:
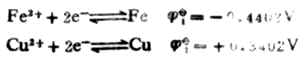
标准电动势为:Eφ=

2-

1=0.4402-(-0.4402)
=0.7804(V)。
因为Eφ<0.2V,可直接用

值判断反应进行的方向。

2>

1,表明Cu2+是比Fe2+更强的氧化剂,Fe是比Cu更强的还原剂所以上述反应可自发地向右进行。
为了证明这个结论的正确性,我们可以按非标准态的电池反应计算电动势。
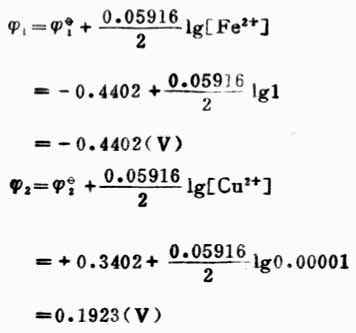
电池电动势为:E=

2-

1=0.1923-(-0.4402)
=0.6325(V)
因为E<0,上述反应可自发地向右进行。
例10 判断298K时反应
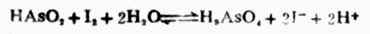
当[HAsO2]=[H3AsO4]=1mol.L-1,[I-]=1mol.L-1,在中性和酸性([H+]=1mol.L-1)溶液中反应进行的方向。
解:将上述反应写成两个半反应,并查出它们的标准电极电位:
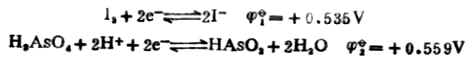
在中性溶液中,[H+]=1.0*10-71mol.L-1。
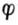
1=

1=+0.535V
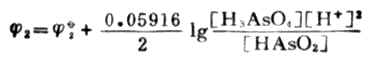
=0.559+0.059161g[H+]
=0.559+0.059161g10-7
=0.559+0.414
=0.145(V)
因为
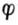
1
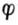
2,所以I2是比H3AsO4更强的氧化剂,而HAsO2是比I-更强的还原
剂。因而上述反应能自发地向右进行。即
HAsO2+I2+2H2O→H3AsO4+2I-+2H+
当溶液中氢离子浓度为1mol.L-1时,
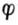
1=

1=+0.535V
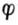
2=

2=+0.559V
因为
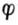
1<
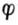
2,所以H3AsO4是比I2更强的氧化剂,而I-更强的还原剂。因而上
述反应能自发地向右进行。即
H3AsO4+2I-+2H+→HAsO2+I2+2H2O
二、判断氧化还原反应进行的程度
氧化还原反应属可逆反应,同其他可逆反应一样,在一定条件下也能达到平衡。随着反应不断进行,参与反应的各物质浓度不断改变,其相应的电极电位也在不断变化。电极电位高的电对的电极电位逐渐降低,电极电位低的电对的电极电位逐渐升高。最后必定达到两电极电位相等,则原电池的电动势为零,此时反应达到了平衡,即达到了反应进行的限度。利用能斯特方程式和标准电极电位表可以算出平衡常数,判断氧化还原反应进行的程度。若平衡常数值很小,表示正向反应趋势很小,正向反应进行得不完全;若平衡常数值很大,表示正向反应可以充分地进行,甚至可以进行到接近完全。因此平衡常数是判断反应进行程度的标志。
氧化还原K与反应中两个电对的标准电极电位的关系为:
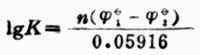
(6-4)
式中,n—反应中得失电子数;

1—正反应中作为氧化剂的电对的标准电极电位;

2—正反应中作为还原剂的电对的标准电极电位。
由式(6-4)可见,

1与

2之差值愈大,K值也愈大,反应进行得也愈完全。
例11 计算下列反应在298K时的平衡常数,并判断此的以应进行的程度。
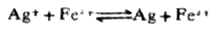
解: 电极反应Ag++e-→Ag
 1=+0.7996V
1=+0.7996V
Fe2+→Fe3++e-[img]yiyonghuaxue123.gif" v:shapes="_x0000_i1029">2=+0.77V
[imgz]yiyonghuaxue204.jpg" alt="二、判断氧化还原反应进行的程度" />
此反应平衡常数很小,表明此正反应进行得很不完全。
例12 计算下列反应的298K时的平衡常数,并判断此反应进行的程度。
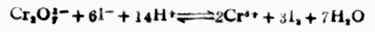
解:
电极反应 Cr2O72-+14H++6e-+→2Cr3+7H2O

1=+1.33V
2I-→I2+2e-

1=+0.535V
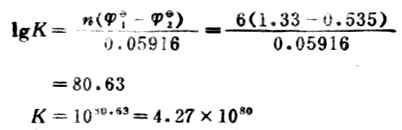
此反应的平衡常数很大,表明此正反应能进行完全,实际上可以认为能进行到底。
例13 向0.45mol.L-1铅盐溶液中加锡,发生下列反应,

计算298K时反应的平衡常数,达到反应限度时溶液中Pb2+浓度为多少。
解:
电极反应:Pb2++2e-→Pb

1=-0.1263V
Sn→Sn2++2e-

2=-0.1364V
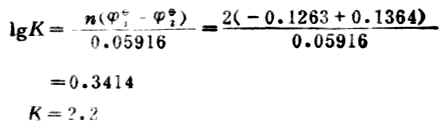
设平衡(达到反应限度)时溶液中Pb2+浓度为χmol.L-1。

χ 0.45-χ
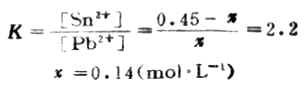
即达到反应限度时溶液中Pb2+浓度为0.14mol.L-1。
三、 电位法测定溶液的PH值
如果有H+或OH-参加电极反应,则H+浓度对电极电位会有影响。把这个电极作为指示电极和一个参比电极组成电池,测定电池电动势,就可以算出指示电极的电位,溶液中H+浓度即溶液的PH值。
所谓指示电极就是这一电极的电位与溶液中某种离子浓度的关系符合能斯特方程式。从它所显示的电位可以推算出溶液中这种离子的尝试通常把这种电极看作是待测离子的指示电极。测定溶液的PH值,就是测定溶液中H+浓度,因此要采用氢离子指示电极。所谓参比电极是指电极电位稳定且已知其准确数值的电极。
(一)参比电极
测定溶液的PH值常用饱和甘汞电极作为参比电极。
饱和甘汞电极的构造如图6-4所示。饱和甘汞电极由两个玻璃套管组成。内管上部为汞,连接电极引线。在汞的下方充填甘汞(HgCL2)和汞的糊状物。内管的下端用石棉或脱脂棉塞紧。外管上端有一个侧口,用以加入饱和氯化钾溶液,不用时侧口用橡皮塞塞紧。外管下端有一支管,支管口用多孔的素烧瓷塞紧,外边套以橡皮帽。使用时摘掉橡皮帽,使与外部溶液相通。
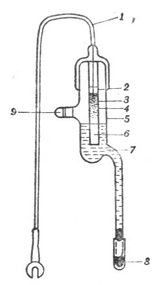
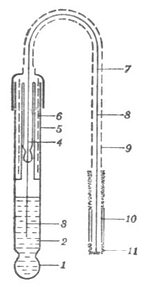
图6-5 玻璃电极
图6-4 饱和甘汞电极1.玻璃球膜,2.缓
1.电极引线 2.玻璃管,3.汞,4.甘示糊 冲溶液,3.银-氯化银电极,
(Hg2Cl2和Hg研成的糊),5.玻璃外套,6. 4.电极导线,5.玻璃管,6.
石棉或纸浆,7.饱和KCl溶液,8.素烧瓷 静电隔离层,7.电极导线,8
,9.小橡皮塞 .金属隔离罩,10.塑料绝缘
线,11.电极接头
饱和甘汞电极的组成式为:
KCl(饱和),Hg2Cl2(固),Hg(l)│Pt
其电极反应式为:

根据能斯特方程式,298K时电极电位为:
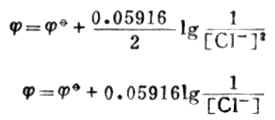
式中

值是定值,在饱和溶液中[CL-]也为定值,故饱甘汞电极的电极电位为定值,298k 时为0.2412V。
饱和甘汞电极的电位稳定,再现性好,而且装置简单,容易保养,使用方便,因此广泛地用作参比电极。
(二)指示电极
常用的PH指示电极为玻璃电极。
玻璃电极的构造如图6-5所示。在玻璃管的下端连接一个厚度为50-100um的半球形玻璃膜。膜内盛有0.1mol ·L-1盐酸称参比溶液。在参比溶液中插入一根镀有氯化银的银丝,构成氯化银电极,为内参比电极。氯化银电极的电极反应为:

电极电位的能斯特方程式为:
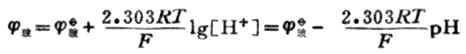
将氯化银电极的银丝与导线相连即构成玻璃电极。玻璃电极可表示为:
Ag,AgCl(s)│HCl(mol.L-1)│玻璃膜│待测溶液(H+)
因为玻璃电极内充液中CL-浓度为一常数,故内参比电极的电极电位值也为常数。
玻璃电极在使用前应先在蒸馏水中浸泡12-24h,使玻璃膜外侧硅酸盐层吸水膨润形成一层水化凝胶层。玻璃膜内侧浸泡在盐酸中,也形成一层水化凝胶层。
当将浸泡过的玻璃电极插入具有一定PH值的待测溶液中时,在玻璃膜外侧溶液中氢离子与膜外水化凝胶层中钠离子进行交换。玻璃膜内侧参比溶液中的氢离子与膜内水化凝胶层中钠离子进行交换。当膜两侧H+浓度不同,离子交换达到平衡时,由于离子交换速度和扩散速度不同而出现了电位差。这种电位差称为膜电位。由于膜内参比溶液的氢离子浓度为定值,所以膜电位仅由膜外溶液的氢离子浓度决定。膜电位值与H+浓度的关系符合能斯特方程。
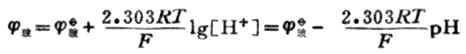
式中

玻值与内参比电极的电极电位、膜内溶液的H+浓度以及膜表面状态有关。在一定条件下,每一个玻璃电极的

玻为常数.
(三)电位法测定溶液的PH值
电位法测 定溶液的PH值常用饱和甘汞电极作参比电极,玻璃电极作指示电极,置于待测溶液中组成如下电池。
Ag│AgCl(s),Cl-(0.1mol.L-1),H+(0.1mol.L-1)│玻璃膜│待测pH溶液 ‖KCL(饱和),Hg2Cl2(s)│Hg(1
测出的电动势为饱和甘汞电极和玻璃电极的电位差值,即
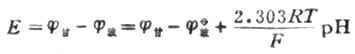
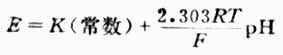
上式为溶液PH值与电池电动势的关系式。测出E值值后,若是不知道常数K的数值,还是不能算出PH值。因此要先用已知PH值为PHs的标准缓冲溶液进行测测定,测出电动势为Es,则可得关系式为:
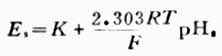
(6-6)
求出K值,
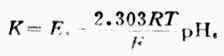
将电池装置中的标准缓冲溶液换成待测pHx的溶液,测出电动势为Ex,则
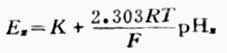
(6-7)
将式(6-7)代入式(6-8)得:
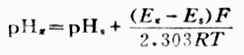
(6-9)
式中PHs 为已知数、Ex和 Es为先后两次测出的电动势,F,R,T为常数,故可根据式(6-9)计算出待测溶液的PH值。
