淋巴器官是以淋巴组织为主构成的器官,依据结构和功能的不同分为两类。①中枢淋巴器官(central lymphoid organ):包括胸腺和骨髓,它们是淋巴细胞早期分化的场所。淋巴干细胞在中枢淋巴器官内分裂分化,成为具有特异性抗原受体的细胞。中枢淋巴器官发生较早,出生前已发育完善,能连续不断地向周围淋巴器官及淋巴组织输送处女型淋巴细胞。中枢淋巴器官不受抗原刺激的直接影响。②周围淋巴器官(peripheral lymphoid organ):如淋巴结、脾和扁桃体,它们在机体出生后数月才逐渐发育完善,中枢淋巴器官不断地将淋巴细胞输入周围淋巴器官。周围淋巴器官是进行免疫应答的主要场所,无抗原刺激时其体积相对较小,受抗原刺激后则迅速增大,结构也发生变化,抗原被清除后以又渐恢复原状。
(一)胸腺
1.胸腺的结构胸腺在胚胎早期由鳃沟外胚层和咽囊内胚层的上皮发生而成,故其早期原基是含有外胚层和内胚层的上皮组织;在淋巴干细胞迁入后,渐变为一种特殊的淋巴组织。小儿胸腺为薄片状粉红色软组织,分左右两叶,表面有薄层结缔组织被膜(capsule)。被膜结缔组织成片状伸入胸腺实质形成小叶间隔(interlobualr septum),将胸腺分成许多不完整的小叶。每个小叶分为皮质和髓质两部分。皮质内胸腺细胞密集,故着色较深;髓质含较多的上皮细胞,故着色较浅。小叶髓质常在胸腺深部相互连接(图9-6)。
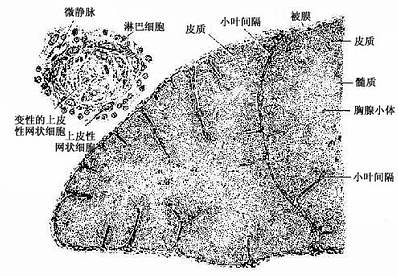
图9-6 小儿胸腺
(1)皮质(cortex):皮质以上皮细胞为支架,间隙内含有大量胸腺细胞和少量巨噬细胞等(图9-7,9-8)。
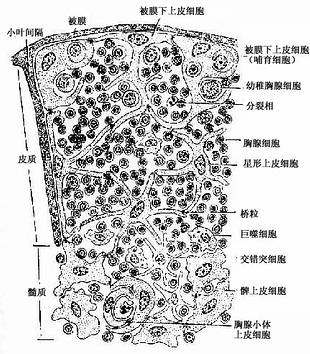
图9-7 胸腺内细胞分布模式图
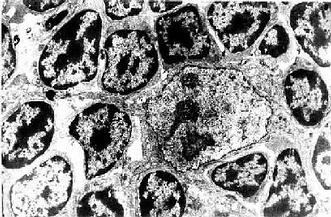
图9-8 大鼠胸腺皮质电镜像 ×7800
(白求恩医科大学尹昕、朱秀雄教授供图)
胸腺上皮细胞:皮质的上皮细胞有被膜下上皮细胞(subcapsular epithelial cell)和星形上皮细胞(stellate epithelial cell)两种。被膜下上皮细胞与结缔组织相邻的一侧呈完整的扁平上皮状,有基膜,相邻细胞间有许多桥粒连接,细胞的另一侧则有一些突起。有的细胞的胞质较丰富,胞质内含有一些内吞的胸腺细胞(图9-7),类似胸腺分离细胞中所见的哺育细胞(nurse cell)。哺育细胞为一大的圆形或椭圆形细胞,胞质内含有数个乃至数十个胸腺细胞,有的还进行有丝分裂,它们是Th细胞的前身。被膜下上皮细胞能分泌胸腺素和胸腺生成素。星形上皮细胞即通常所称的上皮性网状细胞(epithelial reticular cell),细胞多分支状突起,突起间以桥粒相互连接成网,细胞表面标志不同于被膜下上皮细胞,但与胸腺小体上皮细胞的相同。表面具有大量的MHC抗原。此种细胞不分泌激素,其质膜紧贴胸腺细胞,有诱导胸腺细胞发育分化的作用。
胸腺细胞(thymocyte):即T细胞的前身,它们密集于皮质内,占胸腺皮质细胞总数的85%~90%。淋巴干细胞迁入胸腺后,先发育为体积较大的早期胸腺细胞(约占3%)。它们经增殖后成为较小的普通胸腺细胞,其特点为开始出现T细胞抗原受体(TCR),且渐表达CD4和CD8抗原,此种细胞约占胸腺细胞总数的75%,它们对抗原尚无应答能力。普通胸腺细胞正处于被选择期,凡能与机体自身抗原相结合或与自身MHC抗原不相容的胸腺细胞(约占95%)将被灭活或淘汰,少数选定的细胞则继续分化,从而建立符合机制需要的淋巴细胞TCR库。进一步成熟的普通胸腺细胞,其CD4和CD8之中有一种增强,另一种减弱或消失,结果CD4+的细胞约占2/3,CD8+的细胞占1/3。
(2)髓质(medulla):髓质内含大量胸腺上皮细胞和一些成熟胸腺细胞、交错突细胞和巨噬细胞。上皮细胞有两种(图9-7):①髓质上皮细胞(medullary epithelial cell),呈球形或多边形,胞体较大,细胞间以桥粒相连,间隙内有少量胸腺细胞。髓质上皮细胞是分泌胸腺激素的主要细胞。②胸腺小体上皮细胞(thymic corpuscle epithelial cell),它构成胸腺小体(thymic corpuscle),胸腺小体直径30~150μm,散在分布于髓质内,由上皮细胞呈同心圆状包绕排列而成,是胸腺结构的重要特征。小体外周的上皮细胞较幼稚,细胞核明显,细胞可分裂;近小体中心的上皮细胞较成熟,胞质中含有较多的角蛋白,核渐退化;小体中心的上皮细胞则已完全角质化,细胞呈嗜酸性染色,有的已破碎呈均质透明状,中心还常见巨噬细胞或噬酸性粒细胞。胸腺小体上皮细胞不分泌激素,功能未明,但缺乏胸腺小体的胸腺不能培育出T细胞。髓质内的胸腺细胞数量虽少,但均已成熟,并具有免疫应答的能力。髓质内还有少数散在分布的交错突细胞和巨噬细胞,Th细胞常群集于交错突细胞附近。巨噬细胞也参与胸腺内微环境的形成,其分泌物能促进胸腺细胞的分化。
(3)胸腺的血液供应及血胸腺屏障:几条小动脉从胸腺四周穿越被膜进入小叶间隔,在皮质与髓质交界处形成微动脉,并发出许多毛细血管分布于皮质。这些毛细血管又汇入皮髓质交界处的毛细血管后微静脉,其中有部分微静脉是高内皮的,它是胸腺内淋巴细胞进出血流的主要通道。髓质的毛细血管常为有孔型,汇入微静脉后经小叶间隔及被膜出胸腺。据统计,大鼠胸腺静脉血液中的淋巴细胞数量约为动脉血的1.5倍。
实验表明血液内的大分子物质不易进入胸腺皮质内,说明皮质的毛细血管及其周围结构具有屏障作用,称为血-胸腺屏障(blood-thymus barrier)(图9-9)。血-胸腺屏障由下列数层构成:①连续性毛细血管,其内皮细胞间有完整的紧密连接;②内皮基膜;③血管周隙,其中含有巨噬细胞;④上皮基膜;⑤一层连续的上皮细胞。
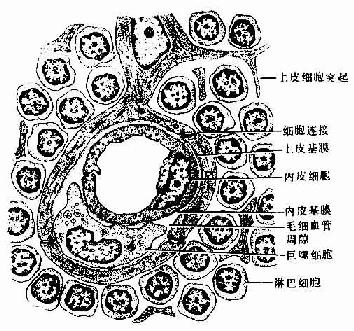
图9-9 血-胸腺屏障结构模式图
近来发现胸腺被膜内的毛细血管是有孔的,血内含有的各种自身抗原分子易经此渗出,进入靠近被膜的胸腺皮质内。这些微量的自身抗原与未成熟的普通胸腺细胞的相应抗原受体结合后,可导致该细胞的灭活或淘汰,从而使胸腺产生的某些T细胞对自身抗原具有免疫耐受性或无应答性。此外;髓质血管的血管周隙较大,其中有多种细胞成分,如T细胞、B细胞、浆细胞、肥大细胞、嗜酸性粒细胞、成纤维细胞和脂肪细胞等;大的血管周隙内还可含有毛细淋巴管,内含较多的淋巴细胞,可能是胸腺输出淋巴细胞的另一条通路。
2.胸腺的功能 胸腺是培育和选择T细胞的重要器官。胸腺上皮细胞分泌的胸腺素(thymosin)和胸腺生成素(thymopoietin)均能促进胸腺细胞的分化,巨噬细胞和交错突细胞也参与胸腺内微环境的形成。胸腺培育出的各种处女型T细胞,经血流输送至周围淋巴器官和淋巴组织。
胸腺有明显的年龄性变化。幼儿期的胸腺较大,重约27g,此后缓慢地退化,皮质渐变薄,胸腺细胞数量渐少,皮质和髓质的境界渐不明显,胸腺小体增大,脂肪细胞渐增多。85岁以后的胸腺,皮质已很少。此外,胸腺还是一个易受损害的器官,急性疾病、肿瘤、大剂量照射或大剂量固醇类药物等均可导致胸腺的急剧退化,胸腺细胞大量死亡与空竭;但病愈或消除有害因子后,胸腺的结构可渐恢复。若切除新生小鼠的胸腺,该动物即缺乏T细胞,不能排斥异体移植物;周围淋巴器官及淋巴组织中无次级淋巴小结出现,机体产生抗体的能力也明显下降。若在动物出生后数周再切除胸腺,此时因已有大量处女型T细胞迁至周围淋巴器官和淋巴组织内,已能行使一定的免疫功能,故短期内看不出影响,但机体的免疫力仍会逐渐下降。若给切除胸腺的新生动物移植一片胸腺,则能明显改善该去胸腺动物的免疫缺陷状态。
胸腺内有丰富的神经末梢,它们终止于胸腺细胞之间或上皮细胞及巨噬细胞附近。胸腺细胞表面有多种神经递质的受体,表明神经对胸腺细胞的发育分化有调节作用。
(二)骨髓
红骨髓是造血器官,又是哺乳动物和人培育B细胞的中枢淋巴器官。骨髓的髓细胞中约有10%属于淋巴细胞系,主要为B细胞系的细胞,细胞散在分布,不形成B细胞岛。淋巴干细胞在骨髓的微环境中先形成大的前B细胞(pre-b cell),约经过4~8次分裂成为中等大小的前B细胞,胞质内已开始合成膜抗体分子。细胞再继续分裂变小,成为幼B细胞(immature B cell),细胞膜上已出现膜抗体SIgM。继而再进一步分化成处女型B细胞(virgin B cell),膜上有SIgM和SIgD分子。处女型B细胞经血循环迁至周围淋巴器官骨髓培育B细胞直至终身。骨髓产生的B细胞比胸腺产生的T细胞数量虽较少,但较为恒定,也不因年龄的增长而减少。
(三)淋巴结
淋巴结是哺乳类特有的淋巴器官。人体的淋巴结共约450个,呈豆形,位于淋巴回流的通路上,常成群分布于肺门、腹股沟及腋下等处,是滤过淋巴和产生免疫应答的重要器官。
1.淋巴结的结构 淋巴结表面有薄层被膜,数条输入淋巴管(afferent lymphatic vessel)穿过被膜通入被膜下淋巴窦。被膜结缔组织伸入实质形成小梁(trabecula)。淋巴结的一侧凹陷称为门部(hilus)此处有较疏松的结缔组织伸入淋巴结内,血管、神经和输出淋巴管(efferent lymphatic vessel)由此进出淋巴结(图9-10)。从门部分支形成的小梁与从被膜伸入的小梁相互连接,构成淋巴结的粗支架,在此粗的网状支架之间充填着网状组织,构成淋巴结的微细支架。淋巴结分为皮质和髓质两部分(图9―10)。
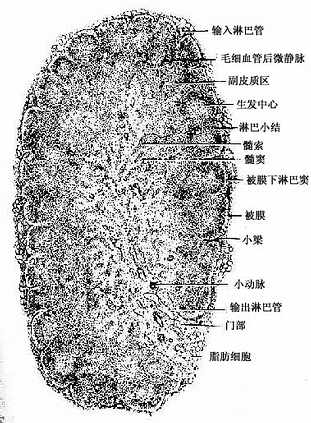
图9-10 淋巴结
(1)皮质:位于被膜下方,由浅层皮质、副皮质区及皮质淋巴窦构成(图9-11)。
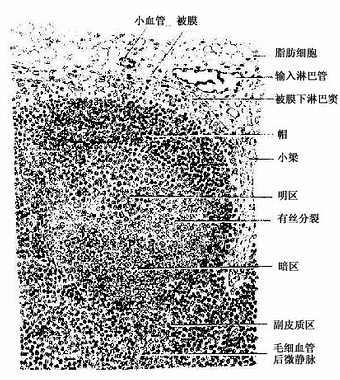
图9-11 淋巴结皮质
浅层皮质(superfacial cortex):为皮质的B细胞区,由薄层的弥散淋巴组织及淋巴小结组成。淋巴小结即在此薄层淋巴组织中发育而成,增大后嵌入深部的副皮质区。当淋巴小结密集时,仅在淋巴小结之间近被膜下淋巴窦处仍有薄层的弥散淋巴组织,也为B细胞区。发育良好的次级淋巴小结的正中切面,可见相当大的生发中心,它可分为暗区和明区两部分(图9-11)。生发中心的顶部及周围有一层密集的小淋巴细胞,以顶部最厚,称为小结帽(cap)(图9-11)。淋巴小结内95%的细胞为B细胞,其余为巨噬细胞、滤泡树突细胞和Th细胞等。生发中心的暗区较小位于生发中心的基部,主要由许多转化的大B细胞组成,细胞的胞质较丰富,嗜碱性强而着色较深。它们经过数次分裂和膜抗体结构突变过程,形成许多中等大小的B细胞。这些B细胞受滤泡树突细胞表面聚集的抗原的选择作用,只有其膜抗体与表面抗原有高度亲和性的细胞能保留继续分裂和分化,其余的则均被淘汰,由明区内的易染体巨噬细胞(tingible-body macrophage)吞噬清除(图9-12)。继续分裂分化的B细胞在明区近帽处形成两类小淋巴细胞:①浆细胞前身,它们随即迁移到髓质,或在其它淋巴器官、淋巴组织或慢性炎症灶处,转变为浆细胞;②B记忆细胞,它们也可迁出淋巴结,并参与淋巴细胞再循环。帽部主要为处女型B细胞,其功能意义未明。
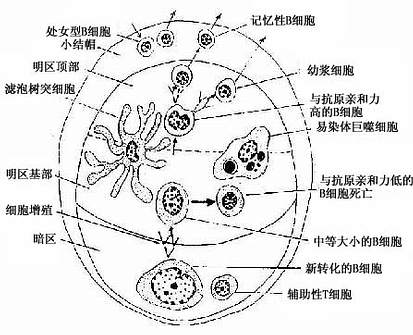
图9-12 淋巴小结的细胞组成及相互关系示意图
副皮质区(paracortex zone):位于皮质的深层,为较大片的弥散淋巴组织,又称深层皮质单位(deep cortex unite),主要由T细胞聚集而成(图9-13)。每个单位与一条输入淋巴管相对应,位于约10数个淋巴小结的深部。整个单位呈半球形,其球面朝向髓质,较平的一面朝向多个淋巴小结。深层皮质单位可分为中央区和周围区。中央区含大量T细胞和一些交错突细胞等,细胞较密集,为胸腺信赖区,新生动物切除胸腺后,此区即呈空竭状。细胞免疫应答时,此区细胞的分裂相增多,并迅速扩大。周围区为包围中央区的一层较稀疏的弥散淋巴组织,含T细胞及B细胞,还有许多高内皮的毛细血管后微静脉,它是血液内淋巴细胞进入淋巴组织的重要通道(图9-14)。血液流经此段时,约有10%的淋巴细胞穿越内皮细胞进入深层皮质单位周围区,再迁移到其它部位。在周围区与髓质邻接处,含有一些小盲淋巴窦(small blind sinus),它们是髓窦的起始部,也是副皮质区淋巴窦的重要通道。
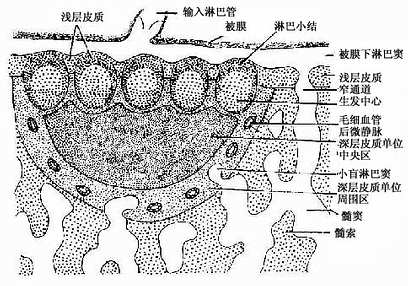
图9-13 淋巴结浅层皮质及深层皮质单位示意图
皮质淋巴窦(cortical sinus):包括被膜下淋巴窦和一些末端常盲端的小梁周窦。被膜下淋巴窦(subcapsular sinus)是包围整个淋巴结实质的大扁囊,其被膜侧有数条输入淋巴管通入。被膜下淋巴窦通过深层皮质单位之间的窄通道与髓窦相通(图9-13)。窦壁有薄的内皮衬里,内皮外有薄层基质、少量网状纤维及一层扁平的网状细胞。淋巴窦内还常有一些呈星状的内皮细胞支撑窦腔,有许多巨噬细胞附着于内皮细胞表面(图9-15)。淋巴在窦内缓慢流动,有利于噬细胞清除异物。若大量抗进入淋巴窦,巨噬细胞即大量增多,淋巴流动更慢。
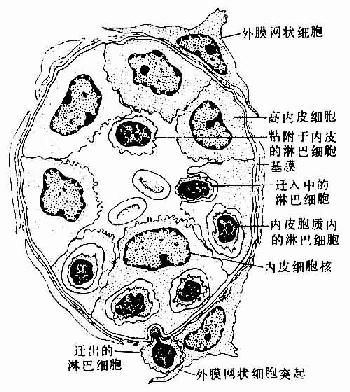
图9-14 淋巴结副皮质区的毛细血管后微静脉模式图
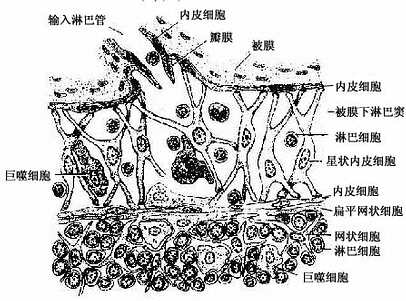
图9-15 被膜下淋巴窦结构模式图
(2)髓质:由髓索及其间的髓窦组成。髓索(medullary cord)是相互连接的索状淋巴组织,索内含B细胞及一些T细胞、浆细胞、肥大细胞及巨噬细胞。髓索中央常有一条扁平内皮的毛细血管后微静脉,是血内淋巴细胞进入髓索的通道。当淋巴回流区有慢性炎症时,淋巴结髓索内的浆细胞明显增多。髓窦(medullary sinus)与皮质淋巴窦的结构相同,但较宽大,腔内的巨噬细胞较多,故有较强的滤作用(图9-16)。
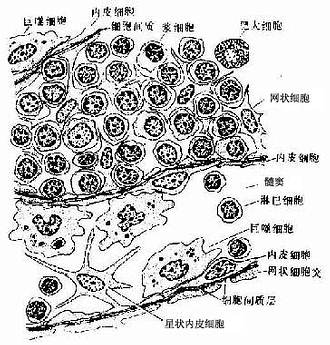
图9-16 淋巴结髓索及髓窦结构模式图
(3)淋巴结内的淋巴通路:淋巴从输入淋巴管进入被膜下淋巴窦,部分淋巴渗入皮质淋巴组织,部分经深层皮质单位之间的窄通道直接流入髓窦,继而汇入输出淋巴管。淋巴流经一个淋巴结一般约需数小时,含抗原愈多则流速愈慢。淋巴经滤过后,其中的细菌等异物即被清除,而输出的淋巴中则含有较多的淋巴细胞和抗体。
2.淋巴细胞再循环周围淋巴器官和淋巴组织内的淋巴细胞可经淋巴管进入血流循环于全身,它们又可通过毛细血管后微静脉再回入淋巴器官或淋巴组织内(图9-17),如此周而复始,使淋巴细胞从一个淋巴器官到另一个淋巴器官,从一处淋巴组织至另一处淋巴组织。这种现象称为淋巴细胞再循环(recirculation of lymphocyte)。除效应性T细胞、幼浆细胞、K细胞和NK细胞以外,大部分淋巴细胞均参与再循环,尤以记忆性T细胞和记忆性B细胞最为活跃。淋巴细胞再循环有利于识别抗原,促进细胞间的协作,使一些具有相关特异性抗原的细胞共同进行免疫应答,并使分散于全身的淋巴细胞成为一个相互关连的有机动性的统一体。参与再循环的淋巴细胞大量位于淋巴器官或淋巴组织内,其总数约为血液中淋巴细胞总数的数十倍,总称为淋巴细胞再循环库。淋巴细胞通过淋巴结再循环一次需18~20小时,通过脾再循环较快,约需2~8小时。一般T细胞的再循环较B细胞快。
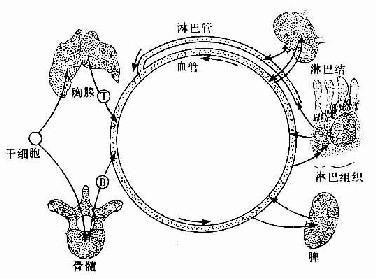
图9-17 淋巴细胞再循环示意图
3、淋巴结的功能
(1)过淋巴液:病原体侵入皮下或粘膜后,很容易进入毛细淋巴管回流入淋巴结。当淋巴缓慢地流经淋巴窦时,巨噬细胞可清除其中的异物,如对细菌的清除率可达99%,但对病毒及癌细胞的清除率常很低。清除率常与抗原的性质、毒力、数量以及机体的免疫状态等密切相关。
(2)进行免疫应答:抗原进入淋巴结后,巨噬细胞和交错突细胞可捕获与处理抗原,使相应特异性受体的淋巴细胞发生转化。识别抗原与细胞间协作的部位在浅层皮质与深层皮质交界处。引起体液免疫应答时,淋巴小结增多增大,髓索内浆细胞增多。引起细胞免疫应答时,副皮质区明显扩大,效应性T细胞输出增多。淋巴结内的T细胞约占淋巴细胞总数的75%,B细胞占25%,大颗粒淋巴细胞极少或无,淋巴结内细胞免疫应答和体液免疫应答常同时发生,以那一种为主视抗原性质而定。淋巴结实质内有许多神经末梢,但淋巴小结内尚未发现。淋巴细胞表面有多种神经递质受体,说明神经系统对淋巴结内的免疫应答有一定的调作用。
(四)脾
脾为人体最大的周围淋巴器官,位于血液循环的通路上,有滤过血液和对侵入血内的抗原起免疫应答等功能。
1.脾的结构脾内也含有大量淋巴组织,但其淋巴组织的分布规律与淋巴结不同。脾无皮质髓质之分,而分为白髓、边缘区和红髓三部分;脾内无淋巴窦,但有大量的血窦(图9-18)
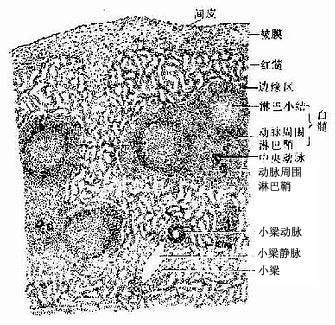
图9-18 脾
(1)被膜与小梁:脾的被膜较厚,表面覆有间皮,被膜结缔组织伸入脾内形成许多分支的小梁,它们与门部分支形成的小梁相互连接构成一粗的支架。被膜和小梁内含有许多散在的平滑肌细胞,其收缩可调节脾内的血量,小梁之间的网状组织构成脾淋巴组织的微细支架。
(2)白髓(white pulp):主要由淋巴细胞密集的淋巴组织构成,在新鲜脾的切面上呈分散的灰白色小点状,故称白髓。它又要分为动脉周围淋巴鞘和淋巴小结两部分。
动脉周围淋巴鞘(periarterial lymphatic sheath):是围绕在中央动脉(central antery)周围的厚弥散淋巴组织(图9-18,9-19),由大量T细胞和少量巨噬细胞与交错突细胞等构成。此区相当于淋巴结内的副皮质区,是胸腺依赖区,但无高内皮毛细管后微静脉。中央动脉旁有一条伴行的小淋巴管,它是鞘内T细胞经淋巴迁出脾的重要通道(图9-19)。当发生细胞免疫应答时,动脉周围淋巴鞘内的T细胞分裂增殖,鞘也增厚。
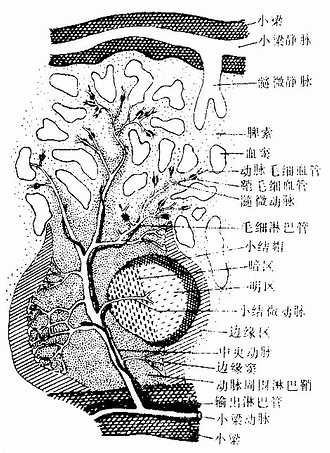
图9-19 脾血液通路模式图
淋巴小结:又称脾小体(splenic corpuscle),结构与淋巴结的淋巴小结相同,主要由大量B细胞构成,发育较大的淋巴小结也呈现生发中心的明区与暗区,帽部朝向红髓(图9-19)。健康人脾内淋巴小结很少。当抗原侵入脾内引起体液免疫应答时,淋巴小结大量增多,它出现于边缘区和动脉周围淋巴鞘之间,使中央动脉常偏向鞘的一侧。
(3)边缘区(marginal zone):位于白髓和红髓交界处,宽约100μm。该区的淋巴细胞较白髓稀疏,但较脾索密集,并混有少量红细胞。此区含有T细胞及B细胞,并含有较多的巨噬细胞。从肌髓或胸腺迁入脾的处女型淋巴细胞常先聚集于此区继续成熟。中央脉侧支分支而成的一些毛细血管,其末端在白髓和边缘区之间膨大形成的小血窦,称为边缘窦(marginal sinus),它是血液以及淋巴细胞进入淋巴组织的重要通道,淋巴细胞也可经此区再迁入动脉周围淋巴鞘、淋巴小结或脾索内。边缘区也是脾内捕获抗原、识别抗原和诱发免疫应答的重要部位,它相当于淋巴结浅层皮质与副皮质的交界处。
(4)红髓(red pulp):约占脾衬质的2/3,分布于被膜下、小梁周围及边缘区外侧,因含有大量血细胞,在新鲜脾切面上呈现红色。红髓由脾索及血窦组成(图9-20)。
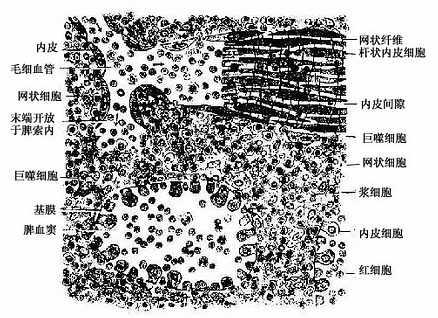
图9-20 脾索与脾血窦模式图
脾索(splenic cord):由富含血细胞的索状淋巴组织构成,脾索在血窦之间相互连接成网,索内含有T细胞、B细胞和浆细胞,以及许多其他血细胞和巨噬细胞,是脾进行滤血的主要场所。脾索内各类细胞的分布并不均匀一致。当中央动脉末端分支进入脾索成为髓微动脉时,其周围有薄层密集的淋巴细胞,在鞘毛细血管周围则有密集的巨噬细胞,至毛细血管末端开放于脾索时含血细胞和巨噬细胞较多,而不含血管的脾索部分则散在的淋巴细胞和浆细胞相对较多。
脾血窦(splenic sinus):是一种静脉性血窦,宽约12~40μm,形态不规则,相互连接成网。窦壁由一层长杆状的内皮细胞平行排列而构成。内皮细胞之间常见许多0.2~0.5μm宽的间隙,脾索内的血细胞可经此穿越进入血窦(图9-21,9-22)。内皮外有不完整的基膜及环行网状纤维围绕,故血窦壁如同一种多孔隙的栏栅状结构。在血窦的横切面上,可见杆状内皮细胞沿血窦壁呈点状排列,较粗大的内皮细胞断面中可见有细胞核,并突入管腔(图9-19)。血窦外侧有较多的巨噬细胞,其突起可通过内皮间隙伸向窦腔。
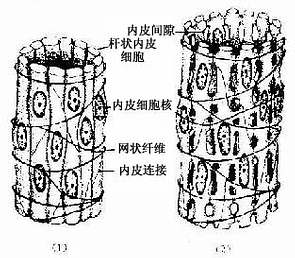
图9-21 脾血窦结构示意图
(1)收缩状态 (2)扩张状态
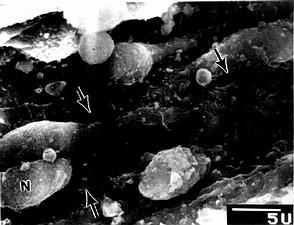
图9-22 大鼠脾血窦扫描电镜像
N内皮细胞核,↑内皮质间隙
2.脾的血液通路 脾动脉从脾门入脾后分支进入小梁,称为小梁动脉(trabecular artery)。小梁动脉分支离开小梁进入动脉周围淋巴鞘内,称为中央动脉。中央动脉沿途发出一些小分支形成毛细血管供应白髓,其末端膨大形成边缘窦。中央动脉主干在穿出白髓进入脾索时分支形成一些直行的微动脉,形似笔毛,故称笔毛微动脉(penicillar arteriole)。笔毛微动脉在脾索内可分为三段(图9-19):①髓微动脉(pulp arteriole),内皮外有1~2层平滑肌;②鞘毛细毛管(sheathed capillary),内皮外有一厚的巨噬细胞鞘,但在人不发达;③动脉毛细血管,毛细血管末端的大部扩大成嗽叭状开放于脾索,少数则直接连通于血窦。血窦汇入由扁平内皮细胞构成的髓微静脉(pulp venule),髓微静脉汇入小梁内的小梁静脉(trabecular vein),最后在门部汇成脾静脉出脾。中央动脉旁的淋巴管沿动脉进入小梁,继而在门部汇集成较大的淋巴管出脾,淋巴内含有许多T细胞。脾内大部分血液流经脾的速度较快,约30秒,少量血液的流速较慢,需数分钟至1小时,依据脾功能状态的不同而有变化。
3.脾的神经分布近十数年对免疫系统各器官内的神经分布有突破性进展,发现淋巴组织内有许多神经末梢,淋巴细胞和巨噬细胞表面有多种神经递质受体,从而改变了过去认为神经不直接调节游离细胞的概念。脾神经入脾门后,其分支除分布于血管及小梁平滑肌以外,还有许多神经末梢进入脾实质分布于动脉周围淋巴鞘和边缘区,红髓的脾索内较少见,淋巴小结内则无。电镜下见到,有的神经末鞘与淋巴细胞之间的间隙仅6nm宽,未见突触形成。说明神经对免疫系统的功能活动有直接的调节作用。
4.脾的功能
(1)滤血:脾内滤血的主要部位是脾索和边缘区,此处含大量巨噬细胞,可吞噬清除血液中的病原体和衰老的血细胞。当脾肿大或机能亢进时,红细胞破坏过多,可引起贫血。脾切除后,血内的异形衰老红细胞大量增多。
(2)免疫:侵入血内的病原体,如细菌、疟原虫和血吸虫等,可引起脾内发生免疫应答,脾的体积和内部结构也发生变化。体液免疫应答时,淋巴小结增多增大,脾索内浆细胞增多;细胞免疫应答时则脉周围淋巴鞘显著增厚。脾内的淋巴细胞中T细胞占40%,B细胞占55%,还有一些K细胞和NK细胞等。
(3)造血:胚胎早期的脾有造血功能,但自骨髓开始造血后,脾渐变为一种淋巴器官,在抗原刺激下能产生大量淋巴细胞和浆细胞。但脾内仍含有少量造血干细胞,当机体严重缺血或某些病理状态下,脾可以恢复造血功能。
(4)储血:人脾的储血能力较小,约可储血40ml ,主要储于血窦内。脾肿大时其储血量也增大,当机体需血时,脾内平滑肌的收缩可将所储的血排入血循环,脾随即缩小。
(五)扁桃体
扁桃体位于消化道和呼吸道的交会处,此处的粘膜内含有大量淋巴组织,是经常接触抗原引起局部免疫应答的部位。
1.腭扁桃体呈卵圆形,粘膜一侧表面覆有复层扁平上皮,上皮向固有层内陷入形成10~30个分支的的隐窝(crypt)。隐窝周围的固有层内有大量弥散淋巴组织及淋巴小结(图9-23)。隐窝深部的复层扁平上皮内含有许多T细胞、B细胞、浆细胞和少量巨噬细胞与郎格汉斯细胞,称为上皮浸润部(图9-24)。上皮内还有一些毛细血管后微静脉,是淋巴细胞进出上皮的主要通道。上皮细胞之间还有许多隧道样细胞间通道,浅表的部分通道直接开口于表面,有的通道开口处覆有一个扁平的微皱褶细胞(microfold cell,M cell)。上皮间隙内以T细胞多,这些经常迁移和更换。上皮内的浆细胞常分布在有孔毛细血管附近,有利于分泌的抗体进入血流。
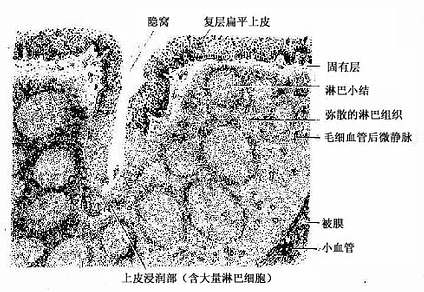
图9-23 腭扁桃体
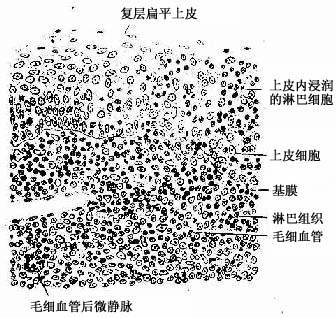
图9-24 腭扁桃体上皮浸润部
小儿的腭扁桃体较发达,其固有层内含有大量弥散淋巴组织及淋巴小结,它们的数量及发育程度与抗原刺激密切相关。扁桃体淋巴组织中的B细胞占淋巴细胞总数的60%,T细胞占385%,还有少量K细胞和NK细胞。弥散淋巴组织中则T细胞较多,也有散在的浆细胞、B细胞和一些毛细血管后微静脉。淋巴小结常较多而大,表明扁桃体与机体的体液免疫功能的关系较密切。固有层内还有一些小淋巴管,淋巴细胞可经此进入淋巴。
2.咽扁桃体咽扁桃体又称腺样体,位于咽的后壁,表面被覆假复层纤毛柱状上皮,无隐窝。粘膜形成一些纵行皱襞,固有层内有许多淋巴组织,上皮内也常见淋巴细胞浸润,浸润部上皮常变为复层扁平上皮。
3.舌扁桃体位于舌根和咽前壁,表面被覆复层扁平上皮,一些较浅的隐窝。上皮内有淋巴细胞浸润部,固有层内含有一些淋巴小结和弥散的淋巴组织,常使舌粘膜向表面隆起呈结节状。
