自由基是指外层轨道上不配对电子的原子、分子或基团,包括超氧阴离子(O2-或H2O-)、羟自由基(-OH)、单线态氧(1O2)、过氧化氢(H2O2)、脂质过氧化物(RO-、ROO-与ROOH)等。正常情况下体内产生少量自由基属正常生理范围。体内同时存在超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POX)等可清除这些对细胞有毒性作用的自由基,故体内自由基的产生和清除处于动态平衡状态。
近30年来,随着氧自由基(oxygen free radical.OFR)及其介导的脂质过氧化反应在疾病中的作用研究日趋深入,自由基与冠心病、动脉粥样硬化发生发展相关的事实正在不断增加,对其损伤机制的认识亦更趋深化。大量基础研究表明,高血脂时体内自由基产生和清除平衡波破坏,许多自由基清除剂(如SOD、CAT)活性降低,产生大量的脂质过氧化物(LPO),这些LPO与AS的形成密切相关。其机制表现为:LPO直接损伤内皮细胞,导致内皮细胞的退行性变化和通透性改变,LPO的产物丙二醛(MDA)极易修饰低密度脂蛋白(LDL),成为MDA-LDL后,能为单核巨噬细胞受体所辨认、内饮,而形成泡沫细胞;炎性细胞浸润并释放各种生长因子,剌激中膜平滑肌细胞移行于内膜增生,吞噬及分泌大量间质成分,形成AS;LPO引起前列环素/血环素A2(PGI2/TXA2)失调,血小板聚集性加强,释放5-羟色胺(5-HT)等,并增强凝血活性。这些因素间又相互影响,相互作用,从而促进AS的形成。分子生物学的最新研究发现,AS病灶中内皮细胞、平滑肌细胞及单核细胞的SiS基因表达明显增强。Gadiparthi等实验发现自由基剌激血管平滑肌细胞的增殖,参与了原癌基因的激活及异常表达,从此基因水平揭示了氧自由基与AS之间的密切关系。
此外,LDL经过多种类型的细胞、过渡金属离子或脂加氧酶的氧化修饰产生氧化修饰LDL(Ox-LDL),Steinberg等从细胞产生氧自由基的角度提出细胞氧化LDL的可能机制(图12-3)。
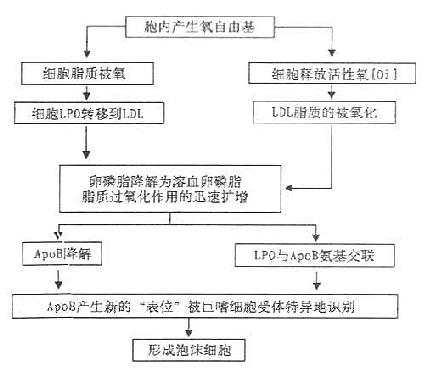
图12-3 细胞氧化修饰LDL的可能机制
Ox-LDL促进AS发展可能通过下述几条途径:①通过乙酰LDL受体(即清道夫受体)途径促进泡沫细胞的形成;②LDL氧化修饰过程中所产生的LPO能抑制HDL的合成,削弱了HDL介导外周组织胆固醇的逆转运,不利于泡沫细胞的消退;③Ox-LDL有细胞毒作用,可损伤内皮,使内皮脱落,进一步引起血栓形成等后果;④Ox-LDL中具有趋化性的脂质使血液中的单核细胞粘附至内皮,进而穿过内皮,进入内皮下间隙;⑤Ox-LDL中对巨噬细胞有抑制作用的脂质阻碍了巨噬细胞的游出,使之聚集在内膜中而有利于AS的形成,此外,Ox-LDL还能直接引起血小板的聚集,促进血栓的形成而有利于AS的发生与发展。
现有资料提示,提高如SOD、CAT等清除自由基酶类的水平,应用药物阻滞LDL的氧化可抑制AS的发生并改变病损的进展。某些研究显示,普罗布可(Probucol)是一种强力的脂溶性抗氧化剂或自由基清除剂。实验说明,该药有延缓泡沫细胞发生的能力,病变部位单核细胞的粘附力降低和进入内膜下间隙的数量明显减少。Probucol类似物、丁羟甲苯及多聚不饱和脂肪酸也不相似的作用。膳食中的抗氧化剂,维生素E与维生素C已肯定潜在的辅助治疗作用,能保护体内LDL免遭氧化修饰从而阻止或延缓SA的发生、发展。由于自由基与AS的形成密切相关,进一步从分子水平,基因水平揭示自由基在AS发生、发展过程中的作用,必将有助于一些困扰临床工作者的诸如再灌注后心肌损伤、心律失常、心力衰竭、脑梗塞等严重问题。为心脑血管病治疗的进一步完善提供新途径。
