是80年代新发展起来的一种诊治癌的方法:病人先静脉注射血卟啉衍生物(Hpd,hematoporphyrin derivative),48-72小时后用紫或蓝绿光照射肿瘤部位,有恶性肿瘤组织处即产生红色的荧光,可以诊断、定位恶性肿瘤;用红光照射肿瘤部位,则会使恶性肿瘤发生坏死。这是因为血卟啉衍生物经静脉注射后,于48-72小时期间一般肿瘤部位的浓度比正常的肌肉、皮肤等其他组织里的浓度高得多;而且血卟啉衍生物被一定波长的紫、蓝绿或紫外光照射后能发出一定波长的红色荧光,被一定波长的红光照射时,因为红光穿透通组织的深度较高,且能使血卟啉衍生物放出能量而破坏含血卟啉衍生物浓度较高的肿瘤组织,从而选择性地破坏肿瘤组织。这种使血卟啉衍生物产生荧光及放出能量破坏组织的反应称光动力反应,利用光和血卟啉衍生物作治疗的方法称为光动力疗法。
一、概况
光动力反应(photodynamicreaction)又称光敏反应、光化学反应。光动力疗法(简称PDT,photodynamic therapy),原称光辐射疗法(PRT,photoradiation therapy),确切地讲,PDT系指特定波长的光照射在一定的光敏物质上时产生的一系列化学、物理、生物等反应。在近百年前已有人观察到这种在生物体中引起的作用,但把这一反应用于人类癌症的诊断和治疗只是在近10年多来才受到重视。1972年Diamond对大鼠移植性胶质瘤进行了实验性研究,他用粗制的血卟啉注入实验大鼠体内,然后用150W白炽灯照射,结果显示大多数移植性肿瘤发生破坏作用,其中少数肿瘤发生部分消退现象。1974、1975年Dougherty用500-1000W光源经滤过成488nm的光,照射注射过Hpd的动物肿瘤时,发现肿瘤被激发而发射出荧光。以后他又报道了用Hpd注入大鼠和小鼠的体内,24小时后进行照光,结果有48%的实验动物肿瘤消失。1975年报道用白光照射动物移植性人膀胱癌后的反应,单独使用Hpd或单独用光照射组均不损伤肿瘤,但注射Hpd后再用光照射,则可看到癌组织明显破坏,而正常的膀胱粘膜却无损伤。1978年Dougherty报道用Hpd注入病人体内后再用一盏白炽灯照射,共照射了113个皮肤和皮下恶性肿瘤,其中111个肿瘤部分或全部消失。这一结果引起全国学者的极大兴趣,目前至少有近20个国家对光动力疗法诊治癌症进行实验和临床研究。
我国于1981年研制出国产的Hpd ,到目前为止已有多个医院在临床上用Hpd进行诊治癌症的研究。此外还有更多的单位进行了实验研究,取得了可喜的结果。
二、光动力疗法诊治肿瘤的理论依据
PDT诊治人体肿瘤,必须具备三个因素:①在肿瘤组织中含有一定浓度的光敏物质;②肿瘤组织中含有分子状态的氧;③适当波长的光。
临床上选用的光敏剂必须具备以下条件:①对人体基本上无毒性;②注入人体后能选择性地贮留在肿瘤组织中,而在短时期内从正常组织中被排泄掉;③能被一定波长的光所激活。
所选用的激励光源应该和光敏剂相适应,即其波长能激活该光敏剂,而且这种波长的光应能穿透一定深度的人体组织。
根据实验研究,Hpd中的大聚合物是PDT诊治癌症的主要成份。有人认为当Hpd注入人体后,开始时Hpd可以通过微血管系统进入正常组织和肿瘤组织,但由于肿瘤组的淋巴回流系统不像正常组织的淋巴系统健全,因此这些大聚合物在肿瘤中贮留的时间要比正常组织长。Hpd有一种非常强的、甚至能在血清中和大聚合物进行自我结合的倾向(分子量达6000,和白蛋白的大小相似)。这些聚合物有可能和其他血清组分一起漏到肿瘤间质的液体中长期停留,并紧紧地结合在肿瘤组织表面,然后逐渐分离而和肿瘤细胞成分主要是和肿瘤细胞膜等结合。经过一定时间,肿瘤周围的Hpd基本上被排泄掉,但肿瘤中仍贮留相当浓度的Hpd,在此时进行光照,就会使肿瘤组织发射荧光或破坏肿瘤。在离体实验中同样有光敏效应的其他卟淋,在循环中则以小分子的方式和血清蛋白相结合,这些卟啉无光动力反应。因为作为一种选择性治疗的必要条件,它们在血清中被清除后不能继续贮留在肿瘤内。
光动力反应激活药物的另一早期反应则明显地发生在肿瘤血管中,如红细胞凝集、血流停止,最后导致血管破坏。有些作者报道光照后首先是肿瘤的血管系统破坏,继而产生肿瘤细胞死亡乃至肿瘤消失。在临床治疗菜花状肿瘤时,我们也常看到许多肿瘤在光照当时即有大量渗液,继而产生较厚的血痂,以后肿瘤才逐渐缩小。
三、激光加光敏剂Hpd的作用
(一)光动力作用的靶部位
关于光动力作用的靶部位,关键在于Hpd能较长时间地贮留在人全某些组织,因此用适当波长的光照射就会引起这些组织的破坏。根据许多实验,Hpd贮留的部位及受光激活后的反应有以下几种。
1. 肿瘤的血管系统
Bugelski、Porlor和Dougherty等报道利用放射自显影方法,看到两组实验动物的癌和肉瘤中,3H-Hpd紧密地和血管基质相结合。卟啉和血管基质结合的量及与肿瘤细胞结合的量相比,大都为5:1。肉瘤和癌两组均是如此,并保持到细胞分裂旺盛时为止。Hpd除了在瘤组织中有较长时间的贮留外,也贮留在组织细胞内,如巨噬细胞、肝柯否氏细胞等。一般来说,小鼠实质细胞可以在24小时内把Hpd从正常组织中清除。
2. 肿瘤细胞
Hpd基本上分布在整个细胞之中,有人认为Hpd主要存在于细胞质的可溶解部分。但是Moan和Berns观察到细胞内的荧光在细胞核周围和核膜层显示得最清楚。由卟啉诱发的光动力反应损伤,能使细胞的多种成分和功能产生变异,例如:膜蛋白的交叉结合、沿细胞膜运转的抑制、酶的活性受影响、酶的丢失以及某些细胞器,如线粒体的影响等。由于细胞核摄取Hpd的量很少,因此照光后发生DNA链断裂和电离辐射相比则要弱得多。Hpd光动力反应引起染色体的损伤,也比X射线照射引起的损伤要小得多。所以,目前大多数学者认为,Hpd光动力反应引起癌细胞的损伤主要发生在细胞器及细胞膜,细胞膜肿胀后可引起膜的完全溶解。
至于恶性细胞和正常细胞对卟啉的亲和力有无差别,有的学者作了一些实验性研究。张氏和Dougherty用相同的培养条件观察了取自正常组织和肿瘤细胞的培养株,结果显示这两种细胞对Hpd的摄取和释放的动力学方面并无区别。Henderson把正常细胞和癌细胞进行混合培养,也未看到它们对Hpd的亲和力有任何区别。
动物实验的研究结果显示了Hpd和DHE(双血卟啉乙醚)在网织内皮细胞,包括巨噬细胞,肥大细胞和肝柯否氏细胞中的摄取和贮留也较常见,因此上述细胞丰富的肝、肾、脾等组织中也贮留了大量的Hpd(在无毒性水平)。皮肤内Hpd的贮留亦可能与皮肤中有大量的巨噬细胞有关,故注射过Hpd的肿瘤病人必须在一定时间内(一般约一个月)避免强光直接照射。前面提到的肿瘤血管基质对Hpd有较强的亲和力,也可能因这些基质中有巨噬细胞和肥大细胞之故。但是也发现在肿瘤细胞内及其周围可以测量到Hpd的贮留时间要比正常组织的细胞长得多,此时血清中已经基本上把Hpd清除。因此有人认为Hpd的选择性亲和力主要取决于肿瘤的组织特性,而不是细胞本身。
3. 单态氧细胞毒
不少作者认为癌细胞在光动力反应损伤作用中,单态氧是主要的因素,单态氧从卟啉中产生的机制可用公式表示:
P+hv→P*(s)
P*(s)→P*(t)
P*(t)+O2→P++1O2*
式中:P卟啉,hv光能,P*激发态的卟啉,s单价态,t三价态,1O激发态的单态氧。
按照以上公式,卟啉的三价态产物,是影响单态氧发生的主要因素。至于Hpd产生单态氧的确实过程,尚不十分清楚。
总的来说光动力反应在肿瘤细胞中的作用机理很可能是以上三种因素的综合作用。血卟啉光动力作用产生单态氧,使癌细胞脂质膜被氧化,膜的结构、转运功能受阻,乙酰胆碱脂酶等酶的活性被抑制,膜蛋白被破坏,细胞能量代谢发生障碍。这些实验结果进一步支持了光敏作用的单态氧作用,并从不同角度说明了细胞膜是光动力损伤作用中的重要靶部位。通过体外培养的多种人恶性肿瘤细胞株和胚二倍体细胞株的一系列生物学实验研究,他们观察到光动力反应作用可严重影响细胞的存活、生长和增殖,损伤线粒体和溶酶体的某些重要酶的活性,破坏细胞质的骨架蛋白,抑制细胞对酪氨酸的摄取及引起细胞形态的许多改变。利用光学显微镜和电子显微镜观察正常小鼠皮肤和脑的光动力反应的组织学和超微结构改变,发现毛细血管内皮细胞损伤出现得最早,程度也最重;而皮肤表皮细胞和脑神经细胞的胞体损伤出现较晚,且程度也较轻。因此可以看出,体内血管损伤和微循环障碍在光动力反应作用机理上可能起着重要作用。
(二)血卟啉衍生物的化学物理性质
Hpd是各种卟啉的聚合物,其中Hpd中的大聚合物是显示光动力杀癌作用的主要成分。
从人体血清中所提炼出来的Hpd的荧光光谱如图5-2-1所示。
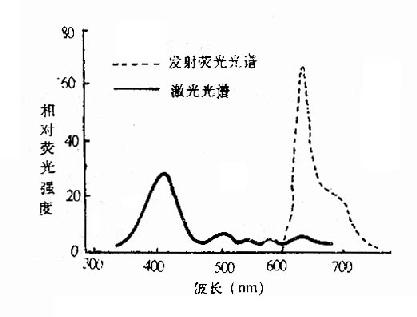
图5-2-1 人血清Hpd的激发光谱和发射荧光光谱
Hpd最佳的激光光谱为波长405nm的紫光,但是波长366nm的长波紫外光、波长406.7-422.6nm紫色的氪离子激光、波长45.9-514.5nm蓝绿色的氩离子激光都能够激发Hpd发出红色荧光,其波长在600-700nm之间,在630、690nm各有一高一低的峰。因为紫光穿透组织太浅,难以用来治疗之用。目前一般均用波长630-631nm的红光作治疗用,取其穿透组织深度最深而且还能使之产生较强烈的细胞毒作用。由于Hpd能选择性地较长时间贮留在肿瘤组织中,因此在病人体内用绿光或紫光照射,可以用来作肿瘤的定位诊断;用630nm红光照射时,则可治疗肿瘤。在这方面,国内外学者已作了大量的实验性研究和临床观察。
(三)光源
有多种光源可用,如早年用的白炽灯、太阳光以及现在仍在使用的氙灯等,只要滤掉不必要的波长后仍有足够强度的绿光、紫光及红光,均可用来作光动力反应的光源。但是要使肿瘤组织内的Hpd发射出足够强度的荧光以及产生足够强度的细胞毒作用,应选择能产生足够强度的相应波长的光。因为激光具有较窄的光带(即单色性)及高强度,因此目前常用激光作为激励光源,如:
(1)氪离子激光器。波长为406.7-422.6nm。
(2)氩离子激光器。波长为457.9-514.5nm。
(3)染料激光器。常用若丹明B、DCM或基酮红染料,用氩离子激光作泵源以后,可产生630nm波长的光束。
(4)金蒸气或铜蒸气激光器。
由于Hpd的最佳吸收峰为405-410nm,因此目前认为氪离子激光为诊断早期肿瘤的最理想的光源,因为氩离子激光泵浦染料激光为最常用的治疗光源,因而也常用氩离子激光作为诊断光源。此外金、铜蒸气激光也常作为较佳的治疗光源。除此之外,一些较价廉的非相干光源正在试用,准分子激光也正在研究。
