杂交瘤抗体技术的基本原理是通过融合两种细胞而同时保持两者的主要特征。这两种细胞分别是经抗原免疫的小鼠细胞作小鼠骨髓瘤细胞。脾淋巴细胞的主要特征是它的抗体分泌功能和能够在选择培养基中生长(选择原理后见),小鼠骨髓瘤细胞则可在培养条件下无限分裂、增殖,即所谓永生性。在选择培养基的作用下,只有B细胞与骨髓瘤细胞融合的杂交才具有持续增殖的能力,形成同时具备抗体分泌功能和保持细胞永生性两种特征的细胞克隆。其原理从下列几个主要步骤阐明。
(一)细胞的选择与融合
建立杂交瘤技术的是制备对抗原特异的单克隆抗体,所以融合细胞一方必须选择经过抗原免疫的B细胞,通常来源于免疫动物的碑细胞。脾是B细胞聚集的重要场所,无论以何种免疫方式刺激,脾内皆会出现明显的抗体应答反应。融合细胞的另一方则是为了保持细胞融合后细胞的不断增殖,只有肿瘤细胞才具备这种特性。选择同一体系的细胞可增加融合的成功率。多发性骨髓瘤是B细胞系恶性肿瘤,所以是理想的脾细胞融合伴侣。目前常用的B细胞瘤株有:P3-X63-Ag8(KǒhlerandMilstein,1975),P3-NSI/1-Ag4-1(KǒhlerandMilstein,1976),X63-Ag8.563(Kearneyetal,1979),Sp2/0-Ag14(Schulmanetal,1978)等,这些细胞株皆为HAT敏感细胞株。
使用细胞融合剂造成细胞膜一定程度的损伤,使细胞易于相互粘连而融合在一起。最佳的融合效果应是最低程度的细胞损伤而又产生最高频率的融合。聚乙二醇(PEG1000~2000)是目前最常用的细胞融合剂,一般应用浓度为40%(W/V)。
(二)选择培养基的应用
细胞融合是一个随机的物理过程。在小鼠脾细胞和小鼠骨髓瘤细胞混合细胞悬中,经融合后细胞将以多种形式出现。如融合的脾细胞和瘤细胞、融合的脾细胞和脾细胞、融合的瘤细胞和瘤细胞、未融合的脾细胞、未融合的瘤细胞以及细胞的多聚体形式等。正常的脾细胞在培养基中存活仅5~7天,无需特别筛选,细胞的多聚体形式也容易死去。而未融合的瘤细胞则需进行特别的筛选去除。
细胞DNA合成一般有两条途径。主途径是由糖和氨基酸合成核苷酸,进而合成DNA,叶酸作为重要的辅酶参与这一合成过程。另一辅助途径是在次黄嘌呤和胸腺嘧啶核苷存在的情况下,经次黄嘌呤磷酸核糖转化酶(HGPRT)和胸腺嘧啶核苷激酶(TK)的催化作用合成DNA。细胞融合的选择培养基中有三种关键成分:次黄嘌呤(hypoxanthine,H)、氨甲蝶呤(aminopterin,A)和胸腺嘧啶核苷(thymidine,T),所以取三者的字头称为HAT培养基。氨甲蝶呤是叶酸的拮抗剂,可阻断瘤细胞利用正常途径合成DNA,而融合所用的瘤细胞是经毒性培养基选出的HGPRT-细胞株,所以不能在该培养基中生长。只有融合细胞具有亲代双方的遗传性能,可在HAT培养基中长期存活与繁殖(图11-1)。
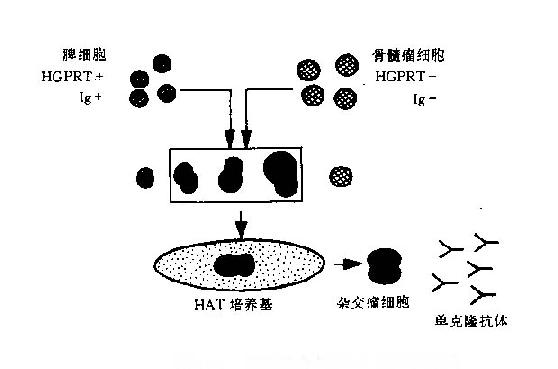
图11-1细胞融合与HAT选择示意图
(三)有限稀释与抗原特异性选择
在动物免疫中,应选用高纯度抗原。一种抗原往往有多个决定簇,一个动物体在受到抗原刺激后产生的体液免疫应答,实质是众多B细胞群的抗体分泌。而针对目标抗原表位的B细胞只占极少部分。由于细胞融合是一个随机的过程,在已经融合的细胞中,有相当比例的无关细胞的融合体,需细筛选去除。筛选过程一般分为两步进行:一是融合细胞的抗体筛选,二是在此基础上进行的特异性抗体筛选。将融合的细胞进行充分稀释,使分配到培养板的每一孔中的细胞数在0至数个细胞之间(30%的孔为0才能保证每个孔中是单个细胞),培养后取上清以ELISA法选出抗体高分泌性的细胞;这一过程常被习惯地称作克隆化。将这些阳性细胞再进行克隆化,应用特异性抗原包被的ELISA找出针对目标抗原的抗体阳性细胞株,增殖后进行冻存、体外培养或动物腹腔接种培养。
