ATP几乎是生物组织细胞能够直接利用的唯一能源,在糖、脂类及蛋白质等物质氧化分解中释放出的能量,相当大的一部分能使ADP磷酸化成为ATP,从而把能量保存在ATP分子内。
ATP为一游离核苷酸,由腺嘌呤、核糖与三分子磷酸构成,磷酸与磷酸间借磷酸酐键相连,当这种高能磷酸化合物水解时(磷酸酐键断裂)自由能变化(G)为30.5KJ/mol,而一般的磷酸酯水解时(磷酸酯键断裂)自由能的变化只有8至12KJ/mol,因此曾称此磷酸酐键为高能磷酸键,但实际上这样的名称是不够确切的,因为一种化合物水解时释放自由能的多少取决于该化合物整个分子的结构,以及反应的作用物自由能与产物自由能的差异,而不是由哪个特殊化学键的破坏所致,但为了叙述及解释问题方便,高能磷酸键的概念至今仍被生物化学界采用。
ATP是一高能磷酸化合物,当ATP水解时首先将其分子的一部分,如磷酸(Pi)或腺苷酸(AMP)转移给作用物,或与催化反应的酶形成共价结合的中间产物,以提高作用物或酶的自由能,最终被转移的AMP或Pi将被取代而放出,ATP多以这种通过磷酸基团等转移的方式,而非单独水解的方式,参加酶促反应提供能量,用以驱动需要加入自由能的吸能反应,ATP水解反应的总结如下:
ATP——→ADP+Pi
或ATP——→AMP+PPi
(焦磷酸)
一、ATP的生成方式
体内ATP生成有两种方式
(一)底物水平磷酸化(substrate level phosphorylation)
底物分子中的能量直接以高能键形式转移给ADP生成ATP,这个过程称为底物水平磷酸化,这一磷酸化过程在胞浆和线粒体中进行,包括有:

(二)氧化磷酸化(oxidative phosphorylation)
氧化和磷酸化是两个不同的概念。氧化是底物脱氢或失电子的过程,而磷酸化是指ADP与Pi合成ATP的过程。在结构完整的线粒体中氧化与磷酸化这两个过程是紧密地偶联在一起的,即氧化释放的能量用于ATP合成,这个过程就是氧化磷酸化,氧化是磷酸化的基础,而磷酸化是氧化的结果。
机体代谢过程中能量的主要来源是线粒体,既有氧化磷酸化,也有底物水平磷酸化,以前者为主要来源。胞液中底物水平磷酸化也能获得部分能量,实际上这是酵解过程的能量来源。对于酵解组织、红细胞和组织相对缺氧时的能量来源是十分重要的。
二、氧化磷酸化偶联部位的测定
确定氧化磷酸化偶联部位通常用两种方法。
(一)P/0值测定
P/0值指在氧化磷酸化过程中消耗一克原子氧所消耗的无机磷的克原子数,或者说消耗一克原子氧所生成的ATP的克分子数。P/0值实质上指的是呼吸过程中磷酸化的效率。
测定P/0值的方法通常是在一密闭的容器中加入氧化的底物、ADP、Pi、氧饱和的缓冲液,再加入线粒体制剂时就会有氧化磷酸化进行。反应终了时测定O2消耗量(可用氧电极法)和Pi消耗量(或ATP生成量)就可以计算出P/0值了。在反应系统中加入不同的底物,可测得各自的P/0值,结合我们所了解的呼吸链的传递顺序,就可以分析出大致的偶联部位了。
表6-3 离体线粒体的P/0比值
| 底物 | 呼吸的组成 | P/0比值 | 生成ATP数 |
| (1)β-羟丁酸 | NAD+→FMN→CoQ→Cyt→O2 | 2.4-2.8 | 3 |
| (2)琥珀酸 | FAN→CoQ→Cyt→O2 | 1.7 | 2 |
| (3)抗坏血酸 | Cyt→Cytaa3→O2 | 0.88 | 1 |
| (4)细胞色素c | Cytaa3→O2 | 0.61-0.68 | 1 |
从上表可以看出P/0值为小数,由于线粒体的偶联作用在离体条件下不能完全发挥,故可认为实际的ATP生成数是他们所接近的正整数值。
比较表中的(1)和(2),呼吸链传递的差异是在CoQ之间,两者ATP的生成数相差1,所以这个ATP的生成部位一定在NAD→CoQ之间。
比较表中(2)和(3),呼吸链传递的差异是在Cyt c之间,两者ATP的生成数相差1,所以这个ATP的生成部位在CoQ→Cyt c之间。
比较表中(3)和(4),生成的ATP数均为1,呼吸链传递的区别是在Cyt c→Cyt aa3,故Cytc→ aa3不存在偶联部位,而在Cyt aa3→O2之间存在着一个偶联部位。
(二)根据氧化还原电位计算电子传递释放的能量是否能满足ATP合成的需要
氧化还原反应中释放的自由能△G'O与反应底物和产物标准氧化还原电位差值(△E'O)之间存在下述关系:△G'O=?nF△E'O
式中n为氧化还原反应中电子转移数目,F为法拉弟常数(23.062千卡/克分子·伏特,或96500库仑/克分子)。
一克分子ATP水解生成ADP与Pi所释放的能量为7.3千卡,凡氧化过程中释放的能量大于7.3千,均有可能生成一克分子ATP,就是说可能存在有一个偶联部位,根据上式计算,当n=2时,△E'O=0.1583V时可释放7.3千卡能量,所以反应底物与生成物的标准氧化还原电位的变化大于0.1583V的部位均可能存在着一个偶联部位。
从图6-11可以看出,在NAD→CoQ,Cyt b→Cyt c和Cyt aa3→O2处可能存在着偶联部位。必须明确,这种计算的基础是反应处在热力学平衡状态,温度为25℃,pH为7.0,反应底物和产物的浓度均为1克分子,这种条件在体内是不存在的。因此这一计算结果只能供参考。
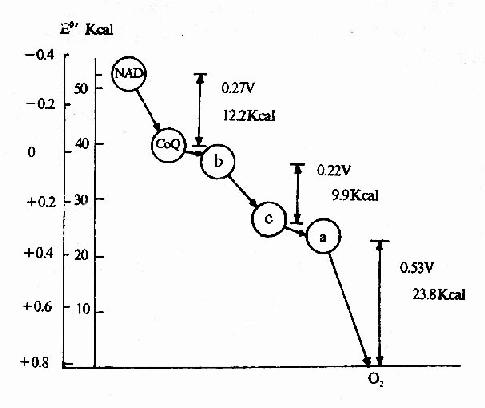
图6-11 呼吸链中电子对传递时自由能的变化
综上所述,呼吸链中电子传递和磷酸化的偶联部位可用图6-12表示。
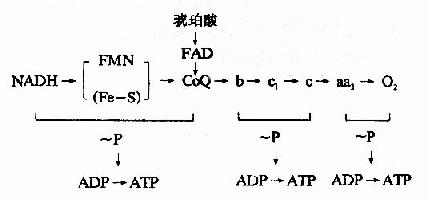
图6-12 偶联部位示意图
呼吸链磷酸化的全过程可用下述方程式表示
NADH+H++3ADP+3Pi+1/2O2→NAD++3ATP+4H2O
FADH2+2ADP+2Pi+1/2O2→FAD+2ATP+3H2O
三、氧化磷酸化中ATP生成的结构基础
ATP是由位于线粒体内膜上的ATP合成酶催化ADP与Pi合成的。ATP合成酶是一个大的膜蛋白质复合体,分子量在480?00kD,是由两个主要组成(或称因子)构成,一是疏水的F0,另一是亲水的F1,又称F0F1复合体。在电子显微镜下观察线粒体时,可见到线粒体内膜基质侧有许多球状颗粒突起,这就是ATP合成酶,其中球状的头与茎是F1部分,分子量为350?/P>380kD,由α3、β3、γ、δ、ε等9种多肽亚基组成,β与α亚基上有ATP结合部位;γ亚基被认为具有控制质子通过的闸门作用;δ亚基是F1与膜相连所必需,其中中心部分为质子通路;ε亚基是酶的调节部分,F0是由3?个大小不一的亚基组成,其中有一个亚基称为寡霉素敏感蛋白质(oligomycin?sensitivity?conferringprotein,OSCP),此外尚有一个蛋白质部分为分子量28kD的因子,F0主要构成质子通道(见图6-13)。
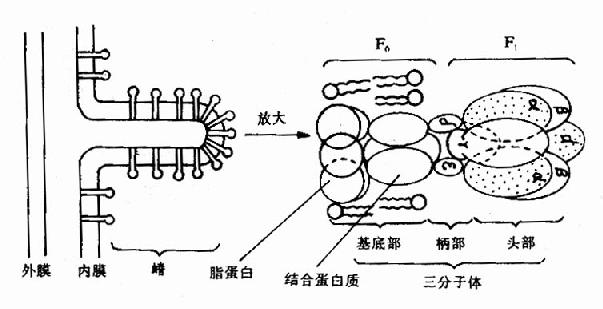
图6-13 线粒体内膜上三联体(三分子体)结构示意图
四、氧化磷酸化的偶联机制
有关氧化磷酸化的偶联机理已经作了许多研究,目前氧化磷酸化的偶联机理还不完全清楚,50年代Slater及Lehninger提出了化学偶联学说,1964年Boear又提出了构象变化偶联学说,这两种学说的实验依据不多,支持这两种观点的人已经不多了。目前多数人支持化学渗透学说(chemiosmotic hypothesis),这是英国生化学家P.Mitchell于1961年提出的,当时没有引起人们的重视,1966年他根据逐步积累的实验证据和生物膜研究的进展,逐步地完善了这一学说。
氧化磷酸化的化学渗透学说的基本观点是:
1.线粒体的内膜中电子传递与线粒体释放H+是偶联的,即呼吸链在传递电子过程中释放出来的能量不断地将线粒体基质内的H+逆浓度梯度泵出线粒体内膜,这一过程的分子机理还不十分清楚(见图6-14)。
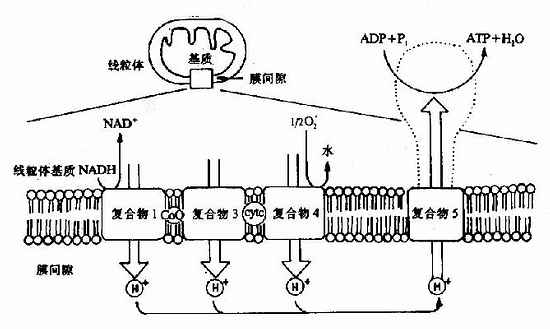
图6-14 电子传递与质子传递偶联(注:复合物Ⅱ未显示)
2.H+不能自由透过线粒体内膜,结果使得线粒体内膜外侧H+浓度增高,基质内H+浓度降低,在线粒体内膜两侧形成一个质子跨膜梯度,线粒体内膜外侧带正电荷,内膜内侧带负电荷,这就是跨膜电位△ψ。由于线粒体内膜两侧H+浓度不同,内膜两侧还有一个pH梯度△pH,膜外侧pH较基质pH约低1.0单位,底物氧化过程中释放的自由能就储存于△ψ和△pH中,若以△P表示总的质子移动力,那么三者的关系可用下式表示:
△P=△ψ-59△pH
3.线粒体外的H+可以通过线粒体内膜上的三分子体顺着H+浓度梯度进入线粒体基质中,这相当于一个特异的质子通道,H+顺浓度梯度方向运动所释放的自由能用于ATP的合成,寡霉素能与OSCP结合,特异阻断这个H+通道,从而抑制ATP合成。有关ATP合成的分子机制目前还不十分清楚。
4.解偶联剂的作用是促进H+被动扩散通过线粒体内膜,即增强线粒体内膜对H+的通透性,解偶联剂能消除线粒体内膜两侧的质子梯度,所以不能再合成ATP。
总之,化学渗透学说认为在氧化与磷酸化之间起偶联作用的因素是H+的跨膜梯度。
每对H+通过三分子体回到线粒体基质中可以生成一分子ATP。以NADH+H+作底物,其电子沿呼吸链传递在线粒体内膜中形成三个回路,所以生成3分子ATP。以FADH2为底物,其电子沿琥珀酸氧化呼吸链传递在线粒体内膜中形成两个回路,所以生成两个ATP分子。
自从Mitchell提出化学通透学说以来,已为大量的实验结果验证,为该学说提供了实验依据。
美国Cohen等人于1978年使用完整的大鼠肝细胞作实验材料,以核磁共振(nuclearmagneticresonance,NMR)的方法直接观察到完整细胞中胞液与线粒体基质之间存在H+跨膜梯度,胞液的pH值比线粒体基质的pH值低0.3单位,用解偶联剂处理,或用氮气代替氧气切断氧的供应,那么胞液和线粒体基质之间的pH梯度消失。
嗜盐菌(halobacteriumhaloblum)是一种能在高浓度盐溶液中生长的细菌,该菌中有一种结合蛋白质,称为菌紫质(bacteriorhodopsin),菌紫质能将光能转换成化学能。有人使用嗜盐菌作实验,在无O2的情况下用光照射嗜盐菌,尽管无氧化作用,菌体内仍维持一定的ATP浓度,若加入解偶联剂或加入磷酸化抑制剂DCC,则菌体内ATP浓度降低;而加入呼吸抑制剂抑制电子传递,即不影响ATP合成,ATP浓度不变,这说明电子传递和H+运动是可以分开加以研究的,嗜盐菌为研究化学渗透学说的H+运动提供了一个理想的模型。于是,有人分离嗜盐菌的菌紫质,并将其重组在人工脂质体中,然后用光照射,可测得跨膜电位为?120mV(内负外正),同时膜外侧H+浓度增高,膜内外△pH约为1.8单位,可以算出总的质子移动力约为△P=-120mV-59×1.8mV=226mV,若再将牛心线粒体内膜重组在此脂质体中,光照后可使ADP+Pi生成ATP,这说明质子跨膜梯度可以经过线粒体内膜的三分子体将H+跨膜梯度中储存的能量转变为ATP分子中的化学能。
五、氧化磷酸化抑制剂
氧化磷酸化抑制剂可分为三类,即呼吸抑制剂、磷酸化抑制剂和解偶联剂。
(一)呼吸抑制剂 这类抑制剂抑制呼吸链的电子传递,也就是抑制氧化,氧化是磷酸化的基础,抑制了氧化也就抑制了磷酸化。呼吸链某一特定部位被抑制后,其底物一侧均为还原状态,其氧一侧均为氧化态,这很容易用分光亮度法(双波长分光亮度计)检定,重要的呼吸抑制剂有以下几种。
鱼藤酮(rotenone)系从植物中分离到的呼吸抑制剂,专一抑制NADH→CoQ的电子传递。
抗霉素A(actinomycinA)由霉菌中分离得到,专一抑制CoQ→Cyt c的电子传递。
CN、CO、NaN3和H2S均抑制细胞色素氧化酶。
(二)磷酸化抑制剂 这类抑制剂抑制ATP的合成,抑制了磷酸化也一定会抑制氧化。
寡霉素(oligomycin)可与F0的OSCP结合,阻塞氢离子通道,从而抑制ATP合成。
二环己基碳二亚胺(dicyclohexylcarbodiimide,DCC)可与F0的DCC结合蛋白结合,阻断H+通道,抑制ATP合成。栎皮酮(quercetin)直接抑制参与ATP合成的ATP酶。
(三)解偶联剂(uncoupler) 解偶联剂使氧化和磷酸化脱偶联,氧化仍可以进行,而磷酸化不能进行,解偶联剂作用的本质是增大线粒体内膜对H+的通透性,消除H+的跨膜梯度,因而无ATP生成,解偶联剂只影响氧化磷酸化而不干扰底物水平磷酸化,解偶联剂的作用使氧化释放出来的能量全部以热的形式散发。动物棕色脂肪组织线粒体中有独特的解偶联蛋白,使氧化磷酸化处于解偶联状态,这对于维持动物的体温十分重要。
常用的解偶联剂有2,4-二硝基酚(dinitrophenol,DNP),羰基-氰-对-三氟甲氧基苯肼(FCCP),双香豆素(dicoumarin)等,过量的阿斯匹林也使氧化磷酸化部分解偶联,从而使体温升高。
过量的甲状腺素也有解偶联作用,甲状腺素诱导细胞膜上Na+-K+-ATP酶的合成,此酶催化ATP分解,释放的能量将细胞内的Na+泵到细胞外,而K+进入细胞,Na+-K+-ATP酶的转换率为100个分子ATP/秒,酶分子数增多,单位时间内分解的ATP增多,生成的ADP又可促进磷酸化过程。甲亢病人表现为多食、无力、喜冷怕热,基础代谢率(BMR)增高,因此也有人将甲状腺素看作是调节氧化磷酸化的重要激素。
六、氧化磷酸化的调节
机体的氧化磷酸化主要受细胞对能量需求的调节
(一)ATP/ADP值对氧化磷酸化的直接影响 线粒体内膜中有腺苷酸转位酶,催化线粒体内ATP与线粒体外ADP的交换,ATP分子解离后带有4个负电荷,而ADP分子解离后带有3个负电荷,由于线粒体内膜内外有跨膜电位(△ψ),内膜外侧带正电,内膜内侧带负电,所以ATP出线粒体的速度比进线粒体速度快,而ADP进线粒体速度比出线粒体速度快。Pi进入线粒体也由磷酸转位酶催化,磷酸转位酶催化OH?与Pi交换,磷酸?二羧酸转位酶催化Pi2-与二羧酸(如苹果酸)交换。
当线粒体中有充足的氧和底物供应时,氧化磷酸化就会不断进行,直至ADP+Pi全部合成ATP,此时呼吸降到最低速度,若加入ADP,耗氧量会突然增高,这说明ADP控制着氧化磷酸化的速度,人们将ADP的这种作用称为呼吸受体控制。
机体消耗能量增多时,ATP分解生成ADP,ATP出线粒体增多,ADP进线粒体增多,线粒体内ATP/ADP值降低,使氧化磷酸化速度加快,ADP+Pi接受能量生成ATP。机体消耗能量少时,线粒体内ATP/ADP值增高,线粒体内ADP浓度减低就会使氧化磷酸化速度减慢。
(二)ATP/ADP值的间接影响 ATP/ADP值增高时,使氧化磷酸化速度减慢,结果NADH氧化速度减慢,NADH浓度增高,从而抑制了丙酮酸脱氢酶系、异柠檬酸脱氢酶、α-酮戊二酸脱氢酶系和柠檬酸合成酶活性,使糖的氧化分解和TCA循环的速度减慢。
(三)ATP/ADP值对关键酶的直接影响 ATP/ADP值增高会抑制体内的许多关键酶,如变构抑制磷酸果糖激酶、丙酮酸激酶和异柠檬酸脱氢酶,还能抑制丙酮酸脱羧酶、α-酮戊二酸脱氢酶系,通过直接反馈作用抑制糖的分解和TCA循环。
七、高能磷酸化合物的储存和利用
无论是底物水平磷酸化还是氧化磷酸化,释放的能量除一部分以热的形式散失于周围环境中之外,其余部分多直接生成ATP,以高能磷酸键的形式存在。同时,ATP也是生命活动利用能量的主要直接供给形式。
(一)高能化合物
人体存在多种高能化合物,但这些高能化合物的能量并不相同。
体外实验中,在pH7.0,25℃条件下,每克分子ATP水解生成ADP+Pi时释放的能量为7.1千卡或30.4千焦耳,在体内,pH7.4,37℃,ATP、ADP+Pi、Mg2+均处于细胞内生理浓度的情况下,每克分子ATP水解生成ADP+Pi时释放的能量为33.5-50千焦耳或8-12千卡(表6-4)。
表6-4 几种常见高能化合物水解时释放的能量
| 化合物 | 千焦耳/克分子 | 千卡/克分子 |
| 磷酸烯醇式丙酮酸 | -62.1 | -14.8 |
| 1,3-二磷酸甘油酸 | -49.5 | -11.8 |
| 磷酸肌酸 | -43.9 | -10.5 |
| 乙酰CoA | -31.4 | -8.2 |
| ATP | -30.4 | -7.3 |
| S-腺苷蛋氨酸 | -29.3 | -7.0 |
| F-6-P | -15.6 | -3.8 |
| 谷氨酰胺 | -14.2 | -3.4 |
| G-6-P | -13.48 | -3.3 |
卫生学规定,中度体力劳动者每日每kg体重需供给能量34-40千卡,若一成人重70kg,从事中度体力劳动,则每日应供应含能量2450千卡的食物,其中40%的能量转变成化学能储存于ATP分子的高能键中,这一部分能量应为2450×0.4=980.0千卡,按每克分子ATP水解生成ADP+Pi释放7.3千卡能量计算,应当合成:980÷7.3=134.3克分子ATP,ATP的分子量为507.22,所以134.3克分子ATP重达68.12kg,这足以表明ATP在体内的代谢十分旺盛。
ATP在能量代谢中之所以重要,就是因为ATP水解时的标准自由能变化位于多种物质水解时标准自由能变化的中间,它能从具有更高能量的化合物接受高能磷酸键,如接受PEP、1,3-二磷酸甘油、磷酸肌酸分子中的~Pi生成ATP,ATP也能将~Pi转移给水解时标准自由能变化较小的化合物,如转移给葡萄糖生成G-6-P。
(二)ATP能量的转移
ATP是细胞内的主要磷酸载体,ATP作为细胞的主要供能物质参与体内的许多代谢反应,还有一些反应需要UTP或CTP作供能物质,如UTP参与糖元合成和糖醛酸代谢,GTP参与糖异生和蛋白质合成,CTP参与磷脂合成过程,核酸合成中需要ATP、CTP、UTP和GTP作原料合成RNA,或以dATP、dCTP、dGTP和dTTP作原料合成DNA。
作为供能物质所需要的UTP、CTP和GTP可经下述反应再生:
UDP+ATP→UTP+ADP
GDP+ATP→GTP+ADP
CDP+ATP→CTP+ADP
dNTP由dNDP的生成过程也需要ATP供能:
dNDP+ATP→dNTP+ADP
(三)磷酸肌酸
ATP是细胞内主要的磷酸载体或能量传递体,人体储存能量的方式不是ATP而是磷酸肌酸。肌酸主要存在于肌肉组织中,骨骼肌中含量多于平滑肌,脑组织中含量也较多,肝、肾等其它组织中含量很少。
磷酸肌酸的生成反应如下:
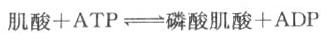
肌细胞线粒体内膜和胞液中均有催化该反应的肌酸激酶,它们是同工酶。线粒体内膜的肌酸激酶主要催化正向反应,生成的ADP可促进氧化磷酸化,生成的磷酸肌酸逸出线粒体进入胞液,磷酸肌酸所含的能量不能直接利用;胞液中的肌酸激酶主要催化逆向反应,生成的ATP可补充肌肉收缩时的能量消耗,而肌酸又回到线粒体用于磷酸肌酸的合成,此过程可用图6-15表示。
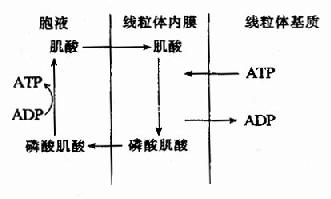
图6-15 磷酸肌酸的生成与利用
肌肉中磷酸肌酸的浓度为ATP浓度的5倍,可储存肌肉几分钟收缩所急需的化学能,可见肌酸的分布与组织耗能有密切关系。
ATP的生成、储存和利用可用下图表示(图6-16)
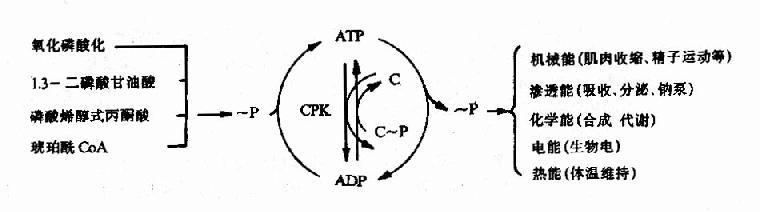
图6-16 ATP的生成、储存和利用总结示意图
CPK:肌酸磷酸激酶
