目前按粘附分子的结构特点可将其分为以下四类:(1)粘合素家族(integrin family)的粘附分子;(2)免疫球蛋白超家族(immunoglobulin superfamily,IGSF)的粘附分子;(3)凝集素家族(selectin family);(4)钙离子依赖的细胞粘附素家庭(Ca2+-dependent cell adhesion molecule family)的粘附分子或称Cadherin。此外还有一些其它未归类的粘附分子。
一、粘合素超家族
国内将integrin译为粘合素、整合素等,本书暂命名为粘合素。integrin是最初在1986年提出的概念,描述一个膜受体家族,此家族的粘附分子主要介导细胞与细胞外基质的粘附,使细胞得以附着而形成整体(integration),故得名。此外,粘合素家族的粘附分子还介导白细胞与血管内皮细胞的粘附。
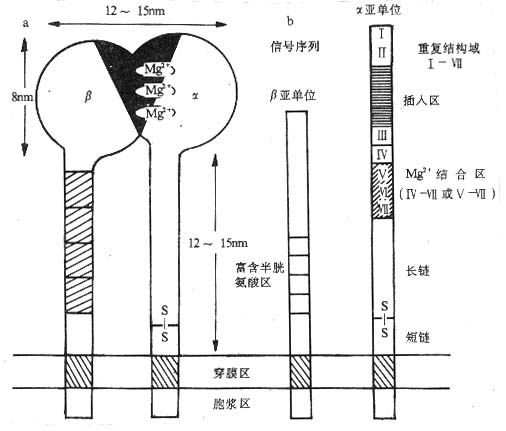
图2-1 integrin分子的结构(示意图)
注:a .integrin分子电镜下所见(模式图),黑区部分显示integrin分子α、β亚单位所 组成的球部,为配体结合域;
b.integrin分子的结构模式图,显示出α亚单位的二价阳离子(Mg2+)结合区和α、 β亚单位的重复序列。
(一)粘合素分子的基本结构
粘合素家族的粘附分子都是由α、β两条链由非共价键连接组成的异源双体(heterodimer),α、β链均为Ⅰ类穿膜蛋白。α链的分子量为120~210kKa,β链的分子量为90~130kDa,个别β链(如β4)分子量为220kDa。不同的α链(或称α亚单位)或β链(或称β亚单位)氨基酸序列有不同程度的同源性,在结构上有其共同的特点。α和β亚单位均由胞膜外区、胞浆区、穿膜区三部分组成。胞浆区一般较短,可能和细胞骨架相联。空膜区富含疏水氨基酸。β亚单位的胞膜外区含有4个富含半胱氨酸的重复序列,靠近外侧N端的40~50kDa的氨基酸残基通过链内二硫键紧密折叠在一起;α亚单位的胞膜外部分有7个同源重复序列,靠近外侧N端的3个或4个重复序列中含有Asp-X-Asp-X-Asp-Gly-X-X-Asp或类似结构,与integrin分子结合二价阳离子(Mg2+)有关,并与β亚单位共同构成粘合素分子的配体结合部位,其中α亚单位的二价阳离子结合区与 integrin分子配体结合的特异性和亲和力有关。某些integrin分子的α亚单位在转录后被剪接为两段,一段为劳作膜部分,较小,约20~30kDa;另一段为胞膜外部分,较大,两者通过二硫键连接起来(图2-1)。电镜下可见integrin分子有一个球状头部,向下伸展有两条杆状结构穿过细胞膜的磷脂双层。
(二)粘合素超家族的组成
目前已知至少有14种α亚单位和8种β亚单位,除α7和αIEL外,其它粘合素分子亚单位均已基因克隆成功。α亚单位和β亚单位组合构成粘合素分子并不是随机的,多数α亚单位只能与一种β亚单位结合构成异源双体,但也有的α亚单位可与几种不同的β亚单位组合,如αV(CD51)可分别同β1、β3、β5、β6和β8亚单位组成integrin分子,而大部分β单位则可以结合数种不同的α亚单位。目前按β亚单位的不同可将粘合素家族分为8个不同的组,在同一组中的粘合素分子不同成员β链相同,α链不同。已知α链和β链有20种组合形式(表2-1),β1、β3、β4、α3和α6等亚单位的mRNA分子可有不同的剪接形式,更增加了粘合素分子的多样性。
(三)粘合素分子的分布
粘合素分子的体内分布很广泛,多数粘合素分子可以表达于多种组织细胞,如VLA组的粘合素分子在体内广泛分布于各种细胞细胞;而多数细胞可同时表达数种不同的粘合素分子,对体外哺乳动物来源的细胞系粘合素分子表达研究发现,每一种细胞系可同时一有达2~10种不同的粘合素分子,但不同类型的细胞表达粘合素分子的种类是不同的。某些粘合素分子的表达则具有明显的细胞类型特性,如gpⅡb/Ⅲa(Ⅱb/β3)主要表在宾巨核细胞和血小板;LAF-1、Mac-1、P150/95只表达在白细胞表面;α6β4特异性表达在上皮细胞。每一种细胞粘合素分子的表达可随其分化与生长状态的改变而变化。
(四)粘合素分子识别配体的短肽序列
粘合素分子在与配体结合时所识别的只是配体分子中由数个氨基酸组成的短肽序列。不同的粘合素分子可能识别相同的短肽序列或同一个配体中不同的短肽序列。由于同一短肽序列可以存在于几种不同的配体中,因此,每一种粘合素分子可能有几种细胞外间质成分做为配体,而每一种细胞外间质中的配体也可能被几种不同的粘合素分子所识别。
1.识别RGD序列的粘合素分子 α5β1、αvβ1、αⅡbβ3、αvβ3、αvβ5、αvβ6都可以识别配体分子中的RGD序列,多种细胞外间质成分(包括FN、VN、FB、vWF)都含有RGD序列,它们在体内的分布极为广泛。含有RGD序列的人工合成肽可以抑制上述粘合素分子与配体的结合。
2.识别非RGD序列的粘合素分子 α2β1、α4β1、αxβ2、αⅡbβ3、α4β7可分别识别其配体分子中DGEA、EILDV、GPRP、KQAGDV、EILDV等短肽序列,其中KQAGDV具有与RGD类似的结构。上述短肽序列可以与RGD序列在于同一个配体分子中,如FN分子中同时存在RGD和EILDN序列。
表2 -1 integrin家族及其相应配体
| 分组 | 成员 | α/β亚单位分子量(kDa) | 亚单位结构 | 分布 | 配体 | 结合位点 |
| VLA组
(β1组) | VLA-1 | 210/130(CD49a/CD29) | α1β1 | 广泛 | CA,LM | |
| VLA-2 | 165/130
(CD49b/CD29) | α2β1 | 广泛 | CA,LM | DGEA | |
| VLA-3 | 135+25/130
(CD49c/CD29) | α3β1 | 广泛 | FN,LM,CA | RGD? | |
| VLA-4 | 150/130
(CD49d/CD29) | α4β1 | 白细胞Mo | FN,VCAM-1 | EILDV | |
| VLA-5(FNR) | 135+25/130
(CD49e/CD29 | α5β1 | 广泛 | FN | RGD | |
| VLA-6(LNR) | 120+30/130
(CD49f/CD29 | α6β1 | 广泛 | LM | ||
| α7β1 | α7β1 | LM | ||||
| α8β1 | α8β1 | ? | ||||
| VNR-β1 | 150/130
(CD51/CD29 | αvβ1 | VN,FN | RGD | ||
| 白细胞粘
附受体组 (β2组) | LFA-1 | 180/95
(CD11a/CD18) | αLβ2 | 白细胞 | ICAM-1
ICAM-2 ICAM-3 | |
| Mac-1 | 165/95
(CD11b/CD18) | αMβ2 | 吞噬细胞大颗粒细胞 | C3bi,FB
X因子, ICAM-1 | ||
| P150,95 | 150/95
(CD11c/CD18 | αXβ2 | 吞噬细胞大颗粒细胞 | FB,C3bi | GPRP | |
| 血小板糖
(β3组) | gpⅡbⅢa | 120+24/105
(CD41/CD61) | αⅡbβ3 | 血小板En,Mo,
PMN | FB,FN,vWF
Thr, | RGD
KQAGDV |
| VNR-β3 | 125+24/105
(CD51/CD61) | αvβ3 | 广泛 | VN,FB,
vWE,Thr FN,CA | RGD | |
| β4组 | α6β4 | 120+30/105
(CD49f/CD104) | α6β4 | 表皮细胞 | LM | |
| β5组 | VNR-β5 | 125+25/110
(CD51/-) | αvβ5 | 广泛 | VN,FN | RGD |
| β6组 | αvβ6 | 125+25/106
(CD51/-) | αvβ6 | FN | RGD | |
| β7组 | α4β7
(LPAM-1) | 150/-
(CD49d/-) | α4β7
αIELβ7 | FN,VCAM-1
? | EILDV | |
| β8组 | αvβ8 | 150/-
(CD51/-) | αvβ8 | ? |
注:FN(fibronectin,纤粘连蛋白)
LM(lamnin,层粘连蛋白)
Thr(thrombospondin,血栓海绵蛋白)
VLA(very alte appearingantigen,很晚出现的抗原)
CA(collagen,胶原蛋白)
VN(vitronectin,玻璃粘连蛋白)
FB(fibronogen,血纤维蛋白)
vWF(von Willebrand factor,von Willebrand 因子)
RGD:Arg-Gly-Asp(精-甘-天冬)
KQAGDV:Lys-Gln-Ala-Gsp-Val(赖-谷氨酰胺-丙-甘-天冬-缬)
DGEA:Asp-Gly-Glu-Ala(天冬-甘-谷-丙)
GPRP:Gly-Pro-Arg-Pro(甘-脯-精-脯)
EILDV:Glu-Ile-Leu-Asp-Val(谷-异亮-亮-天冬-缬)
ICAM-1:intercellular adhesion molecule-1,细胞间粘附分子-1
ICAM-2:intercellular adhesion molecule-2,细胞间粘附分子-2
ICAM-3:intercellular adhesion molecule-3,细胞间粘附分子-3
VCAM-1:vasccular cell adhesion molecule-1,血管细胞粘附分子-1
IEL:intraepithelial lymphocyte, 上皮内淋巴细胞
LPAM-1:leukocyte platelet adhesion molecule-1,白细胞血小板粘附分子-1
3.识别序列尚未明确的粘合素分子 包括α1β1、α6β1、α7β1、α8β1、αLβ2、αMβ2、α6β4、αIELβ7、αvβ8等。
(五)纤维粘连蛋白
integrin分子的配体包括多种细胞外基质成份,其中纤粘连蛋白(fibronectin,FN)与β1、β3、β5、β6和β7等多组integrin分子受体结合,对细胞的生长、分化、活化、移动等过程具有重要的调节作用。
FN的分子量约为550kDa,由α、β两条多肽链构成,两条链在羧基端以二硫键相连。α链和β链的氨基酸组成和结构相似,α链略长。FN由成纤维细胞、血管内皮细胞、巨噬细胞等合成和分泌,通常以两种形式存在:(1)血浆FN,以二聚体形式存在,含量可高达300μg/ml;(2)存在于结缔组织有关的基底膜及多种细胞表面,为多聚体。两种形式的FN结构有所差异。不同种属的FN具有高度同源性,分子中均含有三类同源重复序列,每类重复序列有其特定的肽链折叠方式。①Ⅰ型重复序列(type I repeat):由约45个氨基酸残基构成,分布于FN分子的氨基端和羧基端;②Ⅱ型重复序列(type Ⅱ repeat):由约60个氨基酸组成,插入氨基端Ⅰ型重复序列之间;③Ⅲ型重复序列(type Ⅲ repeat):由约90个氨基酸构成,分布于肽链的中间部分(图2-2)。
不同细胞来源的FN分子结构亦略有差异,这是由于mRNA水平上不同的剪接方式造成的,表现为(1)分子中两个特定位置上Ⅲ型重复序列的存在或缺如;(2)位于FN分子羧基端的可变片段,全长为120个氨基酸残基;不同细胞来源的FN分子多肽链中具有此片段的全部或其中某一部分(图2-2)。在人体内其它分子中也可发现FN分子Ⅰ、Ⅱ、Ⅲ型重复序列的同源序列,如凝血因子Ⅻ分子中有Ⅰ型同源重复序列,凝血酶原中有Ⅱ型同源重复序列,IL-6受体胞外部分含有Ⅲ型同源重复序列。
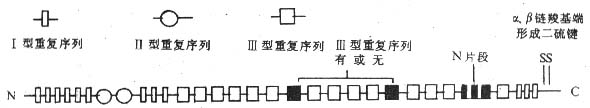
图2-2 纤粘连蛋白分子结构模式图
纤维粘连蛋白分子可以结合多种分子,如胶原蛋白、肝素、血纤维蛋白及细胞表面受体,其中与细胞表面受体的结合主要是通过纤粘连蛋白分子中的RGD序列。
二、免疫球蛋白超家族
在参与细胞间相互识别、相互作用的粘附分子中,有许多分子具有与IgV区或C区相似的折叠结构,其氨基酸组成也有一定的同源性,属于免疫球蛋白超家族(immunoglobulin superfamily, IGSF)的成员。有关免疫球蛋白超家族分子的结构特点和基因结构参见第三章。免疫球蛋白超家族粘附分子的种类、分布及其配体见表2-2。免疫球蛋白超家族粘附分子的配体多为免疫球蛋白超家族的粘附分子或粘合素家族的分子。
有关CD2、CD4、CD8、CD28和CD58分子的结构和功能参见第一章“人白细胞分化抗原”,MHCⅠ类抗原和Ⅱ类抗原参见第六章“主要组织相容性复合体”。本节将简要介绍ICAM和VCAM-1分子的结构。
1.ICAM-1(intercellular adhesion molecule-1) ICAM-1是最早发现的免疫蛋白超家族粘附分子之一,以后又相继发殃了ICAM-2和ICAM-3,它们的免疫球蛋白结构域氨基酸序列具有同源性,且都可以结合LFA-1分子。不同的ICAM分子在体内的分布范围有较大差异,ICAM-1分子分布广泛,如淋巴结和扁桃体血管内皮细胞,胸腺树突状细胞,扁桃体和肾小球上皮细胞,白细胞,巨噬细胞和成纤维细胞等,IL-1、TNF-α、IFN和LPS可促进ICAM-1分子的表达;ICAM-2则分布较局限,主要表达的血管内皮细胞;而ICAM-3只表达在血细胞。ICAM-1分子为单链跨膜糖蛋白,核心多肽为55kDa,由于不同种类细胞上ICAM-1分子所含寡糖分子数有所差别,ICAM-1分子量可在80~11kDa范围。ICAM-1分子胞膜外部分具有5个免疫球蛋白样结构域,第2和第3结构域之间有一段连接序列,富含脯氨酸,类似免疫球蛋白的绞链区,可发生扭曲。以此连接区为界,氨基端的D1和D2结构域可结合LFA-1分子和鼻病毒,而羧基端侧的D3结构域可以结合Mac-1分子(图2-3)。ICAM-2和ICAM-3胞膜外部分分别有2个和5个免疫球蛋白结构域,ICAM-2分子2个结构域与ICAM-1N端2个结构域有34%同源性,ICAM-1D1结构域中结合LFA-1分子具有关键作用。
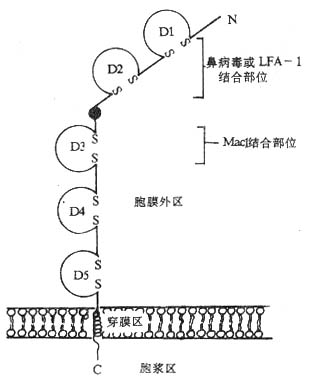
图2-3 ICAM-1分子的结构(模式图)
表2-2 免疫球蛋白超家族(IGSF)粘附分子的种类、分布和识别配体
| IGSF粘附分子 | 分 布 | 分子量(kDa) | 配 体 |
| LFA-2(CD2) | T细胞,胸腺细胞,大颗粒淋巴细胞 | 50 | LFA-3(IHSF) |
| LFA-3(CD58) | 广泛 | 40~65 | LFA-2(IHSF) |
| ICAM-1(CD54) | 广泛 | 80~114 | LFA-1(integrin) |
| ICAM-2(CD102) | 内皮细胞 | 60 | LFA-1(integrin) |
| ICAM-3(CD50) | 外周血静止白细胞 | 140/108 | LFA-1(integrin) |
| CD4 | 抑制细胞诱导亚群,辅助细胞诱导亚群 | 55 | MHC-Ⅱ(IGSF) |
| CD8 | 抑制性T细胞,杀伤性T细胞 | 32/36 | MHC-Ⅰ(IGSF) |
| MHC-Ⅰ | 广泛 | 44/12 | CD8(IGSF) |
| MHC-Ⅱ | B细胞,活化T细胞,活化内皮细胞,巨噬细胞 | 32~34/29~32 | CD4(IGSF) |
| CD28 | T细胞 | 44 | B7/BB1(IGSF) |
| B7/BB1(CD80) | 活化B细胞,活化单核细胞 | 60 | CD28(IGSF) |
| NCAM-1(CD56) | 神经元,胚胎细胞,NK | 120,140,180 | NCAM-1(IGSF) |
| VCAM-1(CD106) | 内皮细胞,上皮细胞,树突细胞,巨噬细胞 | 100,110 | VLA-4(integrin) |
| PECAM-1(CD31) | 白细胞,血小板,内皮细胞 | 140 | PECAM-1(IGSF) |
注:LFA:淋巴细胞功能相关抗原
VCAM:血管细胞粘附分子
NCAM:神经细胞粘附分子
ICAM:细胞间粘附分子
PECAM:血小板内皮细胞粘附分子
的氨基酸序列,并同样具有结合LFA-1分子的功能。
其它部分免疫球蛋白超家族粘附分子的结构将在本书有关章节中介绍。
2.VCAM-1(vascular cell adhesion molecule-1)血管细胞粘附分子,又称诱导性细胞粘附分子(vascular cell adhesion ,INCAM),意指在IL-1、TNF-α等细胞因子活化的血管内皮细胞上表达,分子量100kDa或110kDa,最近命名为CD106,VCAM-1的配体是分布在白细胞表面的VLA-4分子。
三、selectin家族
selectin家族最初被称为外源凝集素细胞粘附分子家族(lectin cell adhesion moleculefamily,LEC-CAM family).selectin是由select和lectin两词合并而来,目前国内尚无统一译法,选择凝集素一词似较为妥当。
(一)selectin分子的基本结构
selectin分子为Ⅰ型穿膜的糖蛋白,可分为胞膜外区、穿膜区和胞浆区。selectin家族各成员胞膜外部分有较高的同源性,结构类似,均由三个结构域构成。(1)其外侧氨基端(约120个氨基酸残基)为钙离子依赖的C型外源凝集素结构域(calcium dependent lectin domain),可以结合碳水化合物基团,是selectin分子的配体结合部位;(2)紧邻外源凝集素结构域是表皮生长因子样结构域(epidermal growth factor-like domain),约含35个氨基酸残基,EGF样结构域虽不直接参加配体的结合,但对维持selectin分子的构型是必需的;(3)近胞膜部分是数个由约60个氨基酸残基构成的补体调节蛋白(complement regulatory protein)重复序列或称为补体结合蛋白(complementbinding protein)重复序列,它们与补体受体(如CR1、CR2等)和C4结合蛋白(C4bp)等结构同源。各种selectin分子的穿膜区和胞浆区没有同源性(见图2-4)。selectin分子的胞浆区与细胞内骨架相联,去除胞浆部分的selectin分子虽仍可结合相应配体,却失去其介导细胞间粘附的作用。
(二)selectin家族的组成
目前已发现selectin家族中有三个成员:L-selectin、P-selectin和E-selectin,L、P和E分别表示leukocyte,platelet和endothelium,是最初发现相应selectin分子的三种细胞,故得名。selectin家族成员的细胞分布和相应配体见表2-3。
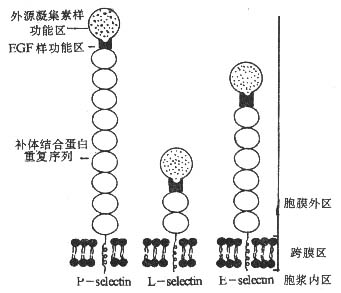
图2-4 selectin分子的结构模式图
表2-3 selectin 家族的组成、分布及其相应配体
| selectin家族成员 | 分布 | 分子量(kDa) | 配体 |
| L-selectin(CD62L,LECAM-1) | 白细胞 | 75~80 | PNAd |
| LAM Mel14(小鼠) | S-Lewisx | ||
| P-selectin | 血管内皮细胞,血小板 | 140 | S-Lewisx |
| (CD62P,GMP-140,PADGEM) | (凝血酶、组胺、白三烯刺激后从α颗粒内与质膜融合而表达在细胞表面) | CD15 | |
| E-selectin(CD62E,ELAM-1) | 血管内皮细胞(主要在毛细血管后静脉,IL-1,TNF活化后表达) | 115 | S-Lewisx
S-Lewisx CLA |
注:LECAM:leukocyteendothelial cell adhesion molecule,白细胞内皮细胞粘附分子
PNAd:peripheral lymphonode vascular addressin,外周淋巴结血管地址素
LAM:leukocyte adhesion molecule,白细胞粘附分子
GMP-140:granule membrane protein-140,颗粒膜蛋白-140
PADGEM:plateletactivation-dependent granule external membrane,血小板活化 依赖性颗粒外膜
ELAM-1:endothelial leukocyteadhesion molecule-1,内皮细胞白细胞粘附分子-1
CLA:cutaneous lymphocyte associated antigen,皮肤淋巴细胞相关抗原
(三)selectin分子识别的配体
与其它粘附分子不同,selectin分子识别的配体都是一些寡糖基团。目前对于这种特殊的受体一配体结合的研究主要采用以下几种方法:(1)抗寡糖决定簇特异性单克隆抗体阻断试验;(2)外源性寡糖分子阻断试验;(3)纯化的内源性寡糖结合试验;(4)特异糖基转移酶改变相应寡糖结构后其结合能力的改变。在研究中可同时采用不同的实验方法从不同的角度分析以期获得正确的结论。迄今为止发现的selectin分子的配体都是具有唾液酸化的路易斯寡糖(Sialyl-Lewis)或类似结构的分子(图2-5)。与蛋白质分子抗原不同,直接决定细胞表面某种寡糖表达的因素是与某些特定的糖基转移酶或碳水化合物修饰酶的作用有关,这些酶的作用可能与细胞的生长与代谢状态有着密切的关联。一种寡糖基团可以存在于多种糖蛋白或糖脂分子上,并分布于多种细胞表面,因此selectin分子的配体在体内的分布较为广泛。如CD15分子可存在于LFA-1、Mac-1 、CR1等不同的糖蛋白分子上,白细胞、血管内皮细胞、某些肿瘤细胞表面及血清中某些糖蛋白分子上都存在有selectin分子识别的碳水化合物基团。

图2-5 路易斯寡糖的结构
注:Gal:半乳糖 Fuc:岩藻糖 Glc:葡萄糖 NAc:N乙酰基 NeuAc:唾液酸
selectin分子对寡糖结构识别的特异性是相对的,它往往可以结合与其特异配体结构类似的寡糖,只是结合的亲和力较低。如P-selectin不仅可以结合CD15分子(lacto-N-fucopen-taose,LNFⅢ的一种异构体LNFⅡ。
四、Cadherin家族
Takeichi最早发现一种介导细胞间相互聚集的粘附分子,在有Ca2+存在时可以抵抗蛋白酶的水解作用,以后又发现两种作用和特性均与其类似的粘附分子,它们的氨基酸序列也有同源性,遂将其命名为Cadherin(Ca2+dependent cell adhesion molecules family)家族。Cadherin家族的粘附分了对于生长发育过程中细胞的选择性聚集具有至关重要的作用。
(一)Cadherin分子的结构
Cadherin分子均为单链糖蛋白,约由723~748个氨基酸构成,不同的Cadherin分子在氨基酸水平上有43~58%的同源性。Cadherin分子为Ⅰ型膜蛋白,由胞膜外区、穿膜区和胞浆区三部分组成。胞膜外区有数个重复结构域,并含有由4~5个氨基酸残基组成的重复序列,近膜部位另有4个保守的半胱氨酸残基,分子外侧N端的113个氨基酸残基构成Cadherin分子的配体结合部位。此外胞膜外部分具有结合钙离子的作用(图2-6)。Cadherin分子的胞浆区高度保守,并与细胞内骨架相连,靠近C端的一半对于Cadherin分子介导的细胞粘附可能具有重要作用,去除此部分的Cadherin分子虽可与配体结合却丧失介导细胞间粘附的作用。推测是由于Cadherin分子与细胞内骨架相连,当Cadherin分子胞膜外区与相应配体结合后,向胞浆内部分传递信号,导致胞浆区与细胞骨架相接,稳定胞膜外区与配体的结合,发挥细胞粘附功能。
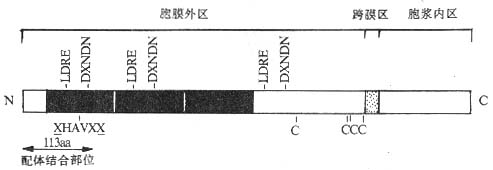
图2-6 Cadherin分子的结构模式图
注:图中黑区部分显示Cadherin分子内重复结构域;LDRE及DXNDN为重复序列。
(二)Cadherin家族的组成和分布
目前已知Cadherin家族共有3个成员:E-Cadherin、N-Cadherin和P-Cadherin。E-Cadherin也被称作Uvomorulin、L-CAM或Cell-CAM120/80。不同的Cadherin分子在体内有其独特的组织分布,它们的表达随细胞生长、发育状态不同而改变。
表2-4 Cadherin家族的组成、分布及其配体
| Cadherin家族成员 | 分子量(kDa) | 主要分布组织 | 配体 |
| E-Cadherin | 124 | 上皮组织 | E-Cadherin |
| N-Cadherin | 127 | 神经组织、横纹肌、心肌 | N-Cadherin |
| P-Cadherin | 118 | 胎盘、间皮组织、上皮细胞 | P-Cadherin |
(三)Cadherin分子识别的配体
Cadherin分子以其独特的方式相互作用,其配体是与自身相同Cadherin分子(图2-7)。以这种方式相互作用的粘附分子除Cadherin家族的粘附分子外,还有属于免疫球蛋白超家族的CD31(PECAM)和CD56(NCAM)。
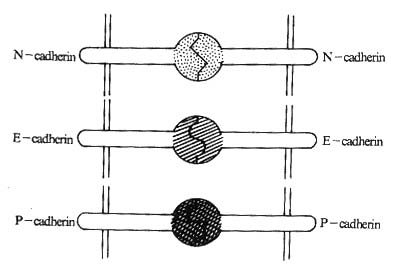
图2-7 Cadherin分子相互作用的模式图
五、其它未归类的粘附分子
除了上述四类粘附分子外,还有一些粘附分子目前尚未归类,包括一组做为selectin分子配体的寡糖决定簇或载有这类寡糖决定簇的糖蛋白,如CD15、S-Lewisx、S-Lewisa;此外还有CD44、MAd、MLA等粘附分子。
(一)selectin分子结合的配体
1.CD15 CD15主要分布在粒细胞表面,是Lewis寡糖的异构体。在第五届白细胞分化抗原国际会议上,将唾液酸化的CD15命名为CD15s。S-Lewisx和S-Lewisa是唾液酸化的路易斯寡糖,两者互为异构体,S-Lewisx主要分布在白细胞、血管内皮细胞及某些肿瘤表面,S-Lewisa主要表达的某些肿瘤细胞。上述寡糖决定簇与多肽连接形成多种糖蛋白存在于某些细胞表面。
2.PNAd和CLA selectin分子的配体还包括有另外一些细胞表面的糖蛋白,包括PNAd和CLA。PNAd(peripheral lymphonode addressin)是表达在外周淋巴结高静脉内皮细胞表面的一组糖蛋白,可与特异性抗L-selectin分子配体的单克隆抗体MECA-79发生反应,分子量在50~200kDa之间,分子上载有唾液酸化的寡糖决定簇。CLA(cutaneous lymphocyte associated antigen)是表达在定向归位于皮肤炎症部位的记忆T细胞表面的一种糖蛋白,分子上存在类似S-Lewisx结构的寡糖决定簇,可与血管内皮细胞表达的E-selectin分子相结合。唾液酸酶处理可以去除PNAd、CLA与selectin分子的结合活性。
(二)CD44
1.CD44分子的结构和分布CD44是一种细胞表面糖蛋白,又称Pgp-1、Ly-24、细胞外基质受体Ⅲ(ECM-RⅢ)和Hermes。CD44分子的基因在转录时可取用不同的外显子使在mRNA水平上有不同的拼接方式,翻译后糖基化的方式和程度也可以不同,导致成熟的CD44分子有多种变异体,按其分子量的不同可大致分为80~90kDa、110~160kDa和180~215kDa三类,每种变异体有其相应的组织分布。仅由组成性外显子编码的氨基酸序列组成的CD44分子称为标准CD44分子(CD44S),有314个氨基酸,其中胞膜外区248个氨基酸,跨膜区21个氨基酸,胞浆区72个氨基酸,核心蛋白分子量为37.2kDa,经糖基化后为80~90kDa,与硫酸软骨素结合后分子量可达180~200kDa。CD44分子胞膜外区靠近N端约100氨基酸范围内有6个Cys,组成三个二硫键,形成一个球形结构,能被Hermes-1、KM-201单抗所识别,可能具有与透明质酸结合的功能。胞膜外有6个N-连接糖基化位点和7个O连接糖基化位点,此外还有4个硫酸软骨素连接位点。Hermes-3McAb识别CD44152~235间的84氨基酸肽段,此区域含有许多亲水氨基酸,折叠后暴露于分子的外侧,Hermes-3McAb能阻断CD44(淋巴细胞)与粘膜HEV上的地址素结合。CD44分子上的硫酸软骨素介导CD44与纤维连蛋白结合。CD44还可与细胞外基质胶原蛋白Ⅰ和Ⅳ及层粘蛋白结合。
CD44分子分布十分广泛,如T细胞、胸腺细胞、B细胞、粒细胞、神经胶质细胞、成纤维细胞和上皮细胞等。
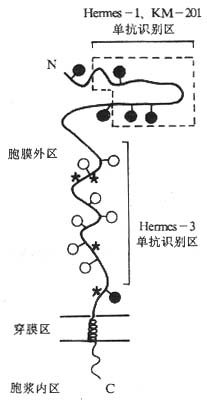
图2-8 CD44分子的结构
注:●- N-连接的糖基化位点
○- ○-连接的糖基化位点
* 硫酸软骨素连接位点
2.CD44分子的变异体CD44多种变异体主要是由于CD44分子基因的不同拼接方式和翻译后不同修饰所造成的。
(1)CD44分子基因的不同拼接方式:人CD44基因定位于11号染色体短臂上,CD44基因有20个高度保守的外显子,每个外显子的长度从70bp到210bp不等,被长短不一的内含子所分隔。CD44基因的外显子按表达方式不同可分为以下两类:①10个组成型外显子(C1~C10),转录片段存在于所有CD44转录产物中。仅由组成型外显子编码的氨基酸序列组成的CD44分子称为标准CD44分子(CD44S)。体内造血细胞(haemopoietic cell)主要表达糖基化的CD44S,称为标准CD44H。②10个变异性拼接外显子(V区外显子,V1~V10),总长为1245bp。这10个V区外显子介于第5和第6个组成型外显子之间(图2-9),其转录产物位于CD44S分子第222个密码子的第一和第二个核苷酸之间。V区外显子可以多种不同的方式进行拼接。参加拼接的V区外显子可多可少,从而产生了不同大小的转录产物。人CD44基因中只有V2~V10外显子,不含V1外显子。含有V区外显子编码的氨基酸序列的CD44分子称为CD44V,目前发现的CD44V有10余种,如CD44V(V2~V10)、CD(V8~V10)、CD44V(V4~V7)、CD44V(V6、V7)、CD44V(V6)等。
(2)CD44分子的翻译后修饰:CD44分子是一种高度糖基化的蛋白,其翻译后修饰包括N-糖基化、O-糖基化和硫酸软骨素侧链的连接。CD44分子中组成性外显子和V区处显子的编码序列均含有糖基化位点和硫酸软骨素侧链的连接位点。CD44分子的胞膜外区N端部分有5个N-糖基化位点,另有一个N-糖基化位点位于近胞膜部位。CD44分子胞膜外区近胞膜部位富含丝氨酸和苏氨酸,是O-连接糖基化位点,在此区域内还存在有丝氨酸-甘氨酸二聚肽结构,被认为是硫酸软骨素连接位点(图2-8)。含V区外显子编码序列的CD44分子经糖基化后分子量可达110~160kDa,而CD44分子与硫酸软骨素分子的连接可使其分子量达180~215kDa。

图2-9 CD44分子的基因结构
3.CD44分子的主要功能CD44是细胞表面的粘附分子,主要参与细胞-细胞,细胞-基质之间的粘附。
(1)CD44分子的配体为细胞外基质,主要有透明质酸、层粘连蛋白、纤粘连蛋白和胶原蛋白等多种配体,不同的CD44分子识别的配体有所差别。如85kDa的CD44分子可结合透明质酸分子的硫酸软骨素侧链可与纤粘连蛋白羧基末端的肝素结合区结合。因此连接有硫酸软骨素侧链的CD44分子可以结合纤粘连蛋白。
(2)CD44分子作为淋巴细胞“归巢”受体(lymphocyte homing receptor)与高内皮静脉(HEV)结合,参与淋巴细胞归位到淋巴组织。
(30)参与T细胞的活化,抗CD44抗体可促进T细胞对抗CD2和CD3抗体的应答,某些抗CD44抗体可提高CD2/LFA-3依赖的T细胞与单核细胞的粘附作用。
(4)与细胞骨架蛋白结合,参与细胞伪足形成和迁移运动。CD44分子胞浆区丝氨酸和苏氨酸磷酸化后,与细胞膜内侧的锚蛋白(ankyrin)结合的亲和力增加,通过锚蛋白与细胞骨架发生连接。
粘膜型地址素(Med)和外周淋巴结型地址素(PNAd)将在本章第三节中加以介绍。
