近年来,补体的分子生物学进展迅猛,对补体系统的活化机理和功能得到了分子水平的解释。各种补体分子的cDNA已克隆成功,绝大多数补体蛋白的基因在染色体上的定位已被确定,并通过对它们的核苷酸序列和氨基酸序列的分析,发现许多补体蛋白的基因在染色体上相连锁,在结构上具有共同性。
一、补体蛋白结构的共同性
通过对补体系统的蛋白结构进一步探查,表现了一些颇具特色的结构功能域(module),并根据它们在氨基酸序列上的同源性,将它们归为几个不同的蛋白家族。同一家族中的各个成员通常具有相类似的结构和功能。此外,根据不同补体蛋白基因间的同源性,提示每个家族的成员可能是由一个共同的祖基因复制而来,出现结构上的多样性,进而使各种补体蛋白又具有各自特定的功能。
(一)C1q与其相关的分子
C1q与其相关的分子:甘露糖结合蛋白(mannose-binding protein,MBP)、肺表面活性物质脱辅基蛋白A和D(surfactantprotein A and D,SP-A,SP-D)、类风湿因子(RF)和胶固素(conglutinin)等,为具有以胶原样蛋白和凝集素区结构为特征的一组蛋白。因此有人将collagen与lectin两字缩合,归纳称为“collectin”(可暂译为胶凝素)。这些相关分子均能以抗体依赖或非依赖的方式被激活,再激活补体系统,或具有结合C1q-R的能力,从而模拟和放大C1q的功能作用。
(二)丝氨酸蛋白酶补体分子
在补体固有成分和调节蛋白中,共有6个丝氨酸蛋白酶(原)。即:C1r、Cls、C2、B因子(Bf)、D因子和I因子。它们除彼此在氨基酸序列上有同源性外,还与非补体性丝氨酸蛋白酶(如胰蛋白酶和糜蛋白酶)高度同源。但C2和Bf的催化部位比常见的丝氨酸蛋白酶约多210个氨基酸残基。在6个补体性丝氨酸蛋白酶中,C1r和C1s,C2和Bf又具有更大的相似性。
C1r和C1s均为单链长形结构,两端呈球形似哑铃状,分子量均为85kDa。二者除在C端有共同的丝氨酸蛋白酶结构功能域外,其N端有约450个氨基酸彼此同源。均含有2个拷贝的SCR和1个拷贝的EGF前体结构功能域(图5-18)。
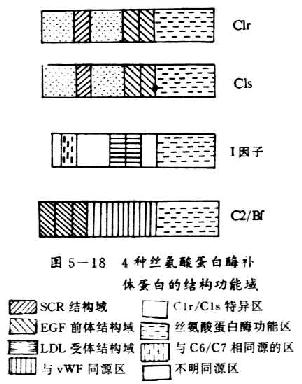
图5-18 4种丝氨酸蛋白酶补体蛋白的结构功能域
C2和Bf均为单肽链糖蛋白,它们除在形成两条补体激活途径中和C3转化酶方面十分相似外,在合成部位、合成途径、分子大小、亚单位结构、半胱氨酸位置及数目,以及保守残基替代及活性部位等方面也有很大的相似性(表5-4)。C2和Bf分子中相同的结构功能域是均有3个CSR、1个与von Willebrand因子(vWF)共同的氨基酸序列和1个丝氨酸蛋白酶结构功能域。
表5-4 C2与Bf的特性比较
| C2 | Bf | |
| 分子量 | 110kDa | 93kDa |
| C2a:75kDa | Bb:63kDa | |
| C2b:35kDa | Ba:35kDa | |
| 血清含量 | ~15mg/L | 150~200mg/L |
| 相得益彰活性部位 | C端侧(C2a) | C端侧(Bb) |
| 氨基酸 | 723 | 733 |
| C2a:509 | Bb:505 | |
| C2b:234 | Ba:234 | |
| 电镜形态 | 3个球状结构 | 3个球状结构 |
| mRNA | 2.9kb | 2.6kb |
| 基因长度 | 18kb | 6kb |
| 3个SCR | 1~65,66~127,128~186 | 4~74,75~136,137~194 |
| 形成的C3转化酶 | C42a | C3bBb |
(三)末端补体分子
末端补体分子C6,C7,C8和C9是构成膜攻击复合体(MAC)引起靶细胞溶解破坏的重要组成成分。功能上的相似性反映了它们结构上的共同性。均具有420kDa的I型凝血敏感蛋白重复序列(thrombospondin type Irepeat,TSP-1),而且与TSP-1特有的β片层、和β螺旋结构的立体配体也是类似的。此种结构单位也存在于备解素(properdin)和疟原虫的羧箕末端。除TSP-1外,它们还具有1个拷贝的低密度脂蛋白受体结构功能域(low density lipoprotein receptor module,LDL-R),1个表皮生长因子前体结构功能域(EGf precusor module)。在肽链的中央还有1个半胱酸贫乏区与细胞毒性细胞和NK细胞释放的perforin的结构具有相似性(图5-19)。其中C6和C7具有更大的同源性。二者除上述的结构功能域外,在C端还存在着富含半胱氨酸的重复序列,即为2个CSR和2个与I因子重链中有一个区具有同源性的结构功能域(factor I module,FIM)。二者的分子量也相近似,分别为128kDa和121kDa。显著的差别仅仅是C6的N端多1个由59个氨基酸组成的TSP-1。
图5-19 末端补体分子的结构功能域
(四)具有SCR的6种补体调节蛋白
补体活化调节蛋白(requlatorof complement activation,RCA)包括:CR1、CR2、H因子、C4bp、DAF和MCP。它们共同的结构特征是均具有多个类似的短同源重复序列(SCR)。SCR也称Shushi单位。一个SCR约由60-70个氨基酸残基所组成,大小为4.5nm。SCR之间有20-40%的同源性。所有的SCR均具有固定的保守骨架序列(其中有4个半胱氨酸形成两个二硫键),并与脯氨酸、色氨酸、酪氨酸/丙氨酸、甘氨酸相维系而形成一独特的结构单位(图5-20)。这一结构单位在CR1中有32个,CR2中有15-16个,H因子中有20个,C4b中有12个,DAF和MCP中各有4个,而且是构成这些补体蛋白肽甸的主要结构。SCR在RCA中的功能是与C3、C4和C5结合,发挥其调节作用。在前述的C1r、Cls、C2、Bf、C6和C7中也含有几种非补体性蛋白如IL-2R、β2糖蛋白1(β2-1)、内皮细胞-白细胞粘附分子-1(ELAM-1)、淋巴细胞的归位受体和凝血因子Ⅻ的b亚单位中也含有SCR,但其意义不详。值得注意的是,牛痘病毒具有SCR的编码DNA,且与C4bp的SCR相类似,可逃避补体经典途径对其发挥作用。
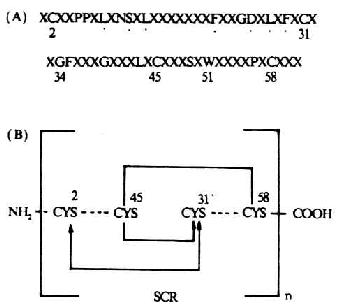
图5-20 SCR的结构(模式图)
注:(A)SCR结构;有44%的SCR是保守的,
包括形成链内二硫键的4个半胱氨酸
(B)具有重迭链内二硫键(……)的SCR
此外,在补体的膜性调节分子中,DAF、MCP、C8bp和CD59四种分子者是以糖基磷酯酰肌醇锚(GPI)而固定在细胞膜上的。锚的核心结构是:protein-CO-NH-CH2-PO4-6-man-α1,2-man-α1,6-man-α1,4-G1CN--α1,6MYO-inositol-1-PO4-Lipid。此种结构还存在于多种非补体蛋白中,如碱性磷酸酶、乙酰胆碱酯酶、Thy-1及布氏锥虫的变异体表面糖蛋白等。补体蛋白DAF、MCP、CD59和C8bp(HRF)可借助于这样的结构而使补体对自身细胞的损伤减至最小。这就是近日逐渐阐明的补体同源限制性(homologous restriction)。阵发性血红蛋白尿(PNH)之所以对补体攻击敏感,正是由于其红细胞膜上缺乏含有GPI锚的分子,因而使机体的正常同源限制性作用失去效能所致。
二、补体的遗传学特征
补体的遗传学特征学特征表现为多种补体分子具有遗传的多态性在染色体上密切连锁的,形成不同的基因家族。
(一)补体的遗传多态性
补体的遗传多态性(geneticpolymorphism)是指在同一集团中,两个或两个以上非连续性突变体或基因型(称型态),以极小的频率有规律地同时发生的现象。补体成分的多态性是Alpert和Propp 1986年在人的C3中首次发现的。此后,已从基因型和表型水平获得有关不同种内补体缺陷与补体多态性的知识,并从四个水平研究了补体的多态性:①通过对血清中天然补体成分同种型的分析(表型水平);②通过确定它们的亚单位组成(亚表型水平);③通过建立群体遗传学和形式遗传学(即同种异型的频率和各个基因/等位基因的频率与分离);④通过对它们DNA结构的定位和测序,提示限制性片段长度多态性(restriction fragment lenght polymorphism, RFLP)。已发现许多补体分子具有多态性,其中以C2、Bf、C4、C3和C6最为显著(表5-5)。
(二)定位于第1号染色体长臂32区的RCA基因簇
这一基因簇包括:CR1、CR2、H因子、C4bp、DAF和MCP的基因。由于这一紧密连锁的基因簇调控着补体系统的活性,因此可以得出下面的结论:基因的连锁是维持密切相关功能的进化的现象。变异体的罕见可能是进行选择的有利条件,或有时是一种致病的因子。例如,所有罕见等位基因CR1※C的携带者,均均患SLE。其他可能的关联尚待阐明。
(三)定位于第5号染色体上的MAC补体基因簇
最近确定在5号染色体的短臂存在着补本末端成分C6、C7和C9的基因簇,并发现C6和C7的基因通常是紧密连锁着的,证据主要来自一个C6/C7联合缺陷的病例。C6缺陷者与反复发作的脑膜炎奈瑟氏菌的感染有很强的相关性。某些C7缺陷的个体也易感染奈瑟氏菌。其余个体则是健康的。惊奇的是所有C9缺陷的个体(1便除外)似乎都健康。这些现象说明,在MAC补体分子中,包括定位于其他染色体的基因编码的C8在内,存在着某种程度的互补性。即一种补体分子的缺陷,可补其他末端补体分子的功能所补偿。C8的3个亚单位(α、β和γ)分别为第1号染色体上的C8A、CIB基因和定位于第9号染色体长臂的基因C8G的产物。
表5-5 补体成分的多态性与染色体定位
| 名 称 | 等位基因总数 | 补体缺陷 | 染色体定位 |
| C1q | - | + | 1p34.1~36.1 |
| C1r,C1s | >5 | + | 13p13 |
| C2 | <10 | + | 6p21 |
| Bf | >20 | 部分 | 6p21 |
| C4 | >30 | + | 6p21 |
| C3 | >30 | + | 19 |
| C5 | 2 | + | 9q32 |
| C6 | >20 | + | 5p |
| C7 | <5 | + | 5p |
| C9 | ? | - | 5p |
| C8α,β | <10 | + | 1 |
| C8γ | 9q | ||
| I因子 | <5 | + | 4 |
| H因子 | <5 | + | 1q32 |
| DAF | 1q32 | ||
| MCP | 1q32 | ||
| C4bp | <5 | - | 1q32 |
| CR1 | <5 | + | 1q32 |
| CR2 | 1q32 | ||
| CR4,α,β | + | 16,21 | |
| CD59 | 11p | ||
| C1INH | + | 12p11.2 | |
| s蛋白 | 27q |
注:表中缺项者为尚末见报道。
(四)定位于第6号染色体短臂21.3区的MHC Ⅲ类基因
已有许多证据表明,C2、C4和Bf由位于MHC I、Ⅲ类基因间一段长80kb的DNA所编码。C2和Bf基因的500kb之中有一部分相重合。C4由2个紧密连锁的位点上的基因C4A(22kb)和C4B(16kb)所编码。纯合性的Bf缺陷尚末见报道,但偶可见一纯合性C4和C2的缺陷。并常与SLE或SLE样疾病相关联。约有2/3纯合性C2缺陷的个体是健康的,说明C2的缺陷至少有一部分可被无缺陷的C4所补偿。C2和Bf均具有多态性。人的C2主要由三个等位基因(C2A、C2B和C2C)所编码。在补体成分的缺陷中,C2的遗传性缺陷所占比使例较高,为常染色体共显性遗传。C2缺陷者发生免疫复合物病及SLE的危险性较大。Bf的遗传多态性最常见的表型为S(slow)和F(fast),另外还发现近20种罕见型,基因频率均<0.02-0.03。B因子的多态性与某些自身免疫病和感染性疾病有关。C4A和C4B则具有复杂的多态性,已发现有30多个同种异型,分别有15和14个等位基因。由C4A和C4B基因编码的两种蛋白有99%的序列同源性,但二者在功能上却有明显的差别。两种同型的差别只是1个决定簇的不同。如将1101位的亮氨酸置换为脯氨酸,在SDS-PAGE上即可出现2kDa的表观分子量的改变;若将1106位的天冬氨酸置换为组氨酸,可使基溶血活性出现3-4倍的变化。另有2个位点含有所谓的“Null”基因称为:“零基因”(C4quantitative zero,C4QO)或静息基因,检不出基因产物的频率为10-20%,系由于基因的缺失、基因转换或不表达所致。C4A和C4B在功能上的送别表现为:①溶血活性不同,C4B明显高于C4A,因C4B与羟因形成酯键的速度大于C4A的10倍,而C4A与氨基形成酰胺键的速度大于C4B的100倍。②C4A在抑制免疫沉淀中的作用较C4B大1.7倍,对腮腺炎病毒的中和作用较C4B大10倍;③抗原性上也有差别;几乎所有C4A分子中都含Rodgers血型抗原,而C4B则含有Chid O血型抗原。C4A缺陷与多种疾病的关联,如SLE、RA、全身性硬化、亚急性硬化性全脑炎(SSPE)、慢性多发性关节炎、重症肌无力、内脏利什曼病、普通变异型肾小球肾炎、麻风、巴西芽生菌病、IgA缺陷、胰岛素依赖的糖尿病(IDDS)、恰加氏病(非洲锥虫病)和艾滋病。
近几年来,已对大多数补体分子的结构和遗传学特征进行了较深入地研究,发现许多补体分子遗传上的异常与某些疾病的关联。但将体外功能上的改变就视为与体内的某一现象有关尚为时过早。今后研究的重要任务,在于阐明补体相关疾病发病机理中的致病因子来取代统计学上的相关性。
(李恩善)
