TCR/CD3复合体中的两个多态型亚单位(TCRαβ或TCRγδ)主要功能是识别结合MHC分子的抗原,而胞浆区非常短;CD3分子的主要功能是参与TCR/CD3复合体的装配和稳定以及信号转导(表8-1)。CD3分子亚单位的胞浆内部分含有一个共同的序列,即D/EX2YX2L/IX8YX2L/I,其中含有两个YXXL/I结构。由于其序列同淋巴细胞抗原识别后淋巴细胞的活化及信号转导关系密切,因而把此序列称为抗原识别活化基序(antigen recognition acivation motifs,ARAMS)其中含有两个YXXL/I结构。由于其序列同淋巴细胞抗原识别后淋巴细胞的活化及信号转导关系密切,因而把此序列称为抗原识别活化基序(antigen recognition activation motifs,ARAMS)。其中CD3γ、ε、δ各含一个ARAM,η链含二个,ζ链含三个。此外,在B细胞受体(b cell receptor ,BCR)α链(Igα、CD79a)和β链(Igβ、CD79b)、FcγRⅢ以及Fcεr I的γ链、FcεR I β链等中也含有类似结构的ARAM。经突变及嵌合分子等研究证实,ARAM是TCR信号转导的结构基础,单独分离的ARAM能够转TCR介导的信号。TCR与抗原结合后可激活一些PTKs,包括TCR相连的p59fyn、ZAP-70(ζassociated protein-70)、CD4/CD8相连的p56lck以及其它src相关的PTKs(图8-2),随后引起多种底物的酪氨酸磷酸化。
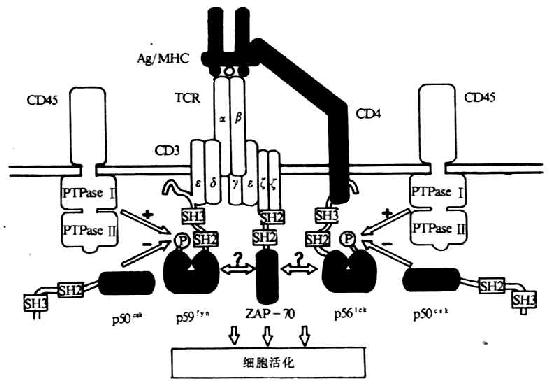
图8-2 TCR与抗原结合后导致一些激酶的活化
目前证实TCR激活的PTKs底物有原癌基因产物Vav、42kDa的微管相关蛋白激酶(Mi-crotubule-associated protein kinase,MAPK)、PLCγ1及CD3ζ链(图8-3)。这些磷酸化的蛋白在信号转导中具有重要作用。
TCR/CD3复合体根据结构特点可分为三组:(1)两个多态型亚单位即TCRβ或TCRγδ,属免疫球蛋白超家族成员,各含有一个V区和一个C1区;(2)CD3γ、δ和ε链,亦属免疫球蛋白超家族成员,各含有一个C2区;(3)ζ和η链,胞膜外区很短,不属于免疫球蛋白超家庭的成员(图8-4)。
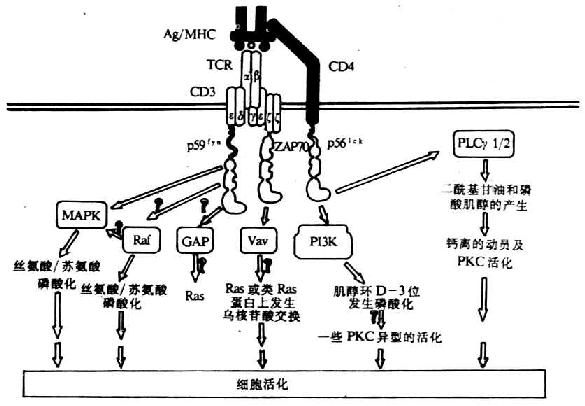
图8-3 TCR同抗原结合后所引起的PTKs底物磷酸化
一、TCRαβ和TCRγδ
TCRαβ和TCRγδ中两个多态型亚单位具有类似免疫球蛋白可变区(V)和恒定区(C)的结构域,其中V区能同抗原特异地结合。αβ或γδ链通常以异源二聚体形式表达在T细胞表面,成熟的T淋巴细胞根据其细胞表面表达的异源二聚体受体类型不同可分为两个亚群:TCRαβ亚群,包括大多数的外周成熟T细胞;TCRγδ亚群,主要是定居在组织上皮中大多数淋巴细胞。
(一)TCRαβ
CD4阳性TCRαβ T细胞可识别非已MHCⅡ类抗原(同种异体抗原)或自身MHCⅡ类抗原与外来抗原复合物。CD8阳性TCRαβT细胞则可识别非已MHC I类抗原或自身MHC I类抗原与外来抗原的复合物。α链分子量44-60kDa,等电点为4.4-4.7;β链40-55kDa,等电点6.0-6.2。α和β链各由一个可变区(V区)和一个恒定区(C区)组成,与Ig的V区和C区大小相似。每个功能区系由二硫键相连的50-60氨基酸残基组成的环肽。此外还有一个穿膜区和一个烄短的含亲水氨基酸的胞浆部分(5个氨基酸残基)。α和β链的连接肽(connecting peptide)处由二硫键连接为双体。在空膜部分各含一个赖氨酸,可能同CD3中γ、ε和δ键穿膜部分的天冬氨酸或谷氨酸形成盐桥,与TCR信号通过CD3传递有关。
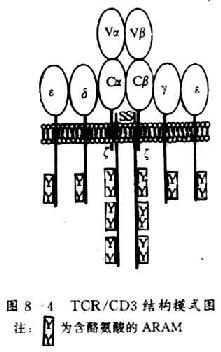
(二)TCRγδ
γ链分子量为40-60kDa,δ链为40-60kDa,γ与δ链由非共价键相连。在小鼠和部分人的TCR中,γ和δ也可由二硫键相连接,这种二聚体中γ和δ链分子量分别为36-40kDa和43kDa。
二、CD3γ、δ和 ε链
CD3ε、γ和δ链的cDNA序列分析表明,它们都属于I型跨膜蛋白,都含有一个约有50氨基酸残基组成的类似免疫球蛋白胞外功能域,编码这些肽链的基因密切连锁,可能起源于同一祖先基因。在复合体中,CD3γ、δ和ε以二种非共价键形式γε和δε异源二聚体存在。
ε链分子量为20-25kDa,从编码ε cDNA推算出多肽链的结构,包括氨基端104个亲水性氨基酸,穿膜部分为26个氨基酸残基,胞浆内为81个氨基酸残基。编码ε基因与δ链基因连锁在一起。研究表明,ε链胞浆内功能域的缺失不会导致明显的信号转导障碍,且缺乏ε链的TCDR/CD3复合体足以产生抗原介导的细胞活化和IL-2的产生。但通过构建嵌合分子进行基因转染试验证实,在缺失ζ链的淋巴细胞中,ε链胞浆功能域可以转导淋巴细胞活化信号。另外,ε和ζ胞浆功能域活化T细胞可引起不同方式的蛋白磷酸化,提示ε和ζ亚单位可能涉及到两种不同的独立的跨膜信号转导生化途径。目前研究发现,ε链主要介导抗原或超抗原(superantigen)的活化信号;ζ链除介导抗原的活化信号外,还可介导经淋巴细胞表面分子(如CD2)以及致有丝分裂原(如PHA、PMA)所产生的活化信号。
三、CD3ζ和η链
从基因水平研究发现,ζ和η链是同一基因的两种不同的拼接形式。ζ链由前1-8外显子编码,而η链是前1-7加上第9外显子编码。在遗传和结构上,与CD3γ、ε和δ三个亚单位不同,ζ和η链只有一个短的细胞外功能域(9个氨基酸残基)。ζ和η链在氨基酸水平的主要差异存在胞浆内,η链比ζ链多42个氨基酸残基,但缺少6个潜在的酪氨酸残基磷酸化位点中的一个。沁ζ、η和Fcεr Iγ多肽链共同表达于同一个细胞时,一个ζ亚单位可同ζ、η或Fcεr Iγ三个亚单位中的任何一个通过二硫键形成三种不同的二致辞体如ζ-ζ、ζ-η或ζ-Fcεγ(Ige Fc I型受体γ链),因此有人将ζ、η和FcεR Iγ链称之为ζ家族(ζfamily)。以TCRαβ多态型为例,可有TCRαβγεδεζζ或TCRαβγεδεηζ不同组合的TCR/CD3复合物,并可能共同存在于同一个细胞表面,把某一抗原与不同信号转导途径连接起来。
(一)ζ链
ζ链绝大多数以同源二聚体即ζ-ζ形式存在,仅有10%以异源二聚体(ζ-η)形式存在。ζ链是一种高度保守的结构,分子量为10kDa,从小鼠ζ链的cDNA推算出信号肽21个氨基酸残基,胞膜外区为9个氨基酸残基,穿膜区21个氨基酸残基,胞浆区113个氨基酸残基。目前已知,ζ链是一种受体激活的蛋白酪氨酸激酶底物,当受体与配体结合后,ζ链很快发生酪氨酸磷酸化,参与淋巴细胞活化信号的转导。用基因转染方法证实,ζ链胞浆内功能域具有将受体结合与细胞内信号转导途径连接起来的功能。目前发现,ζ链并非为TCR/CD3复合体所特有,它可以不依赖CD3的其它亚单位而存在于NK中,并同FcζγRⅢ(CD16)相连。此外,在TCR触发后,ζ链可以同一胞浆内称为ζ链相关蛋白70(ZAP-70)相结合,AP-70为一种胞浆内具有PTK活性的信号蛋白,含有两个SH-2(srchomology region 2,SH-2)结构域以及一个与猪脾中PTK syk相关的激酶结构域,ZAP-70分子中SH-2与ζ链中磷酸化的酪氨酸残基相结合,ζ链的酷氨酸磷酸化是由p59fyn或p56lck催化所致。
(二)η链
小鼠η链分子量为21kDa,可与ζ以异源二聚体形式存在。在人体细胞中至今还缺乏分子水平的证据来证明η蛋白产物及其在细胞中转录物的存在。采用不同探针在体外进行核糖核酸酶保护试验证明,人及某些哺乳动物有η样区产物表达,对其序列分析表明,η样区产物是ζ基因经选择拼接后所产生,但在人类η样区表达水平很低,仅有ζmRNA水平的0.25%.不同物种η样区基因在核苷酸水平高度保守,但由于读框改变使得它们在氨基酸水平无明显同源性。
表8-1 T细胞抗原受体复合体中的蛋白多肽
| 名称 | 功能 | 分子量(kDa) | 多聚体形成 | 特点 | |
| 人 | 鼠 | ||||
| TCRα | 作为MHC-Ag复合体识别受体的肽链 | 45~60 | 44~55 | α β | IGSF成号;基因重排;CD4+或CD8+T细胞 |
| TCRβ | 作为MHC-Ag复合体识别受体的肽链 | 40~50 | 40~55 | α β | IGSF成员;基因重排;CD4+或CD8+T细胞 |
| TCRγ | 作为MHC-Ag复合体识别受体的肽链 | 45~60 | 45~60 | γδ或γγ | IGSF成员;基因重排;为CD4-CD8-T细胞 |
| TCRδ | 作为MHC-Ag复合体识别受体的肽链 | 40~60 | 40~60 | γ δ | IGSF成员;基因重排;主要为CD4-CD8-T细胞 |
| TCRγ | 作为αβ和γδTCDR信号转导分子 | 25~28 | 21 | IGSF成员;丝氨酸残基磷酸化 | |
| TCRδ | 作为αβ和γδTCDR信号转导分子 | 20 | 28 | IGSF成员;丝氨酸残基磷酸化 | |
| TCRε | 作为αβ和γδTCDR信号转导分子 | 20 | 25 | IGSF成员;丝氨酸残基磷酸化 | |
| TCRζ | 作为αβ和γδTCDR信号转导分子 | 16 | 16 | ζζ或ζη | 酪氨酸残基磷酸化 |
| TCRη | 作为αβ和γδTCDR信号转导分子 | ? | 21 | ζη | |
| TCRψ | 参与胞浆内质网 | 28 | 28 | 不表达在细胞表面 | |
| (或TRAP) | CD3分子的装配 | TCR/CD3复合体中 | |||
注:TRAP:T cell receptor-associated protein,T细胞受体相关蛋白
IGSF:immunoglobulin superfamily,免疫球蛋白超家族
在T细胞成熟过程中,TCR/CD3复合体中任何一个亚单位缺陷,可能导致细胞功能低下,甚至引起临床症状。TCR/CD3复合体形成过程通常是按以下顺序进行的;首先CD3γ、δ和ε三种肽链通过形成γ-ε和δ-ε两种异源二聚体成为稳定的复合物核心,TCRαβ(或TCRγδ)与之结合,随后ζ-ζ或ζ-η二聚体同TCRαβ(或γδ)/CD3γεδε复合物结合,最后转移到T细胞表面。CD3γ和δ的缺陷可能影响TCR/CD3复合物的装配和表达。γ-TCRID(TCr immunodeficiencies)患者的TCR/CD3复合物在外周血T细胞膜中的表达较正常人低两倍,可发生腹泻和致命性病毒性肺炎。ε-TCRID患者的TCR/CD3复合物在外周血T细胞膜中表达较正常人低10倍,但这些患者的临床症状较轻微,提示患者T细胞表达的TCR/CD3的功能基本是正常的。
组成TCR/CD3复合体的分子以及这些分子在一系列生化事件中将信号转导核内方面的研究也取得很大进展。TCR通过两种或更多不同的独立的途径中某一途径传递信号,取决于被选择的TCR/CD3和/或TCR/CD3相关分子的活化,这些分子在某个途径起作用,并决定着细胞所获得的效应功能的转归。TCRαβ或γδ克隆型异源二聚体,能同CD4或CD8复合体分子相连,并可具有CD3中ζ-ζ、ζ-η甚至ζ-γ二聚体蛋白,在同一个T细胞中可以表达一种类型以上TCR分子。不同TCR以及它们相关信号转导途径反映了:(1)存着许多功能上不同的T细胞亚群;(2)分化的T细胞对在不同途径中的所需要的条件取决于它们分化的不同阶段。例如:抗原刺激可以诱导某个分化阶段T细胞发生增殖,对另外一群T细胞可能诱导程序性细胞死亡,而在T细胞第三亚群中可能诱导免疫无反应性。另外,单独一个成熟T细胞在免疫应答过程中发挥辅助功能或细胞毒作用,可能同选择与相应受体相连几种信号传递途径的不同有关。
由于分子生物学和基因工程技术的应用,TCR/CD3中新成员以及它们相关分子方面的研究获得了相当大的进展。但是,还不能回答关于抗原刺激如何选择几种信号转导途径中的某一种,以及它们在每个途径中起何作用,因此,涉及到经TCR途径信号转
导的新分子及其作用机理还有待进一步鉴定和阐明。
