免疫电泳技术是电泳分析与沉淀反应的结合产物。这种技术有两大优点,一是加快了沉淀反应的速度,二是将某些蛋白组分利用其带电荷的不同而将其分开,再分别与抗体反应,以此作更细微的分析。免疫电泳技术的种类很多,这里仅将常用的技术介绍如下。
一、免疫电泳
免疫电泳为区带电泳与免疫双向扩散的结合,是由Grabar和Williams(1953)首先报道的。方法是先利用区带电泳技术将不同电荷和分子量的蛋白抗原在琼脂内分离开,然后与电泳方向平行在两侧开槽,加入抗血清。置室温或37℃使两者扩散,各区带蛋白在相应位置与抗体反应形成弧形沉淀线(图12-8)。根据各蛋白所处的电泳位置,可分为白蛋白区、球蛋白α1区、α2区、β区和γ区。各区带常见血浆蛋白见表12-3和图12-9。
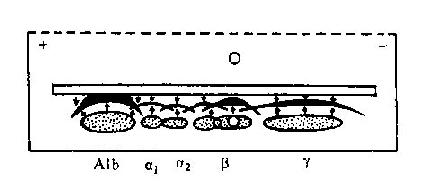
图12-8免疫电泳扩散模式图A1b:白蛋白
表12-3血浆免疫电泳各区带所含蛋白成分
| ALB | α1 | α2 | β | γ |
| 白蛋白 | α1-抗胰蛋白酶 | 触珠蛋白 | 转铁蛋白 | IgG |
| 前白蛋白 | α1-酸糖蛋白 | 铜蓝蛋白 | C3a、C3b | CRP |
| α1脂蛋白 | 抗糜蛋白酶 | 2-巨球蛋白 | IgA、IgM、IgD、纤维蛋白原、β1脂蛋白、血凝素 |
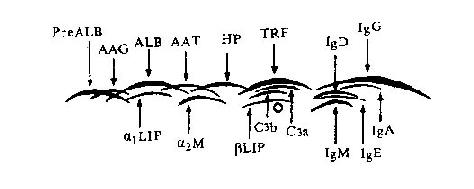
图12-9血浆蛋白各区带位置示意图
PreALB:前白蛋白;HP:触珠蛋白;α1脂蛋白;ALB:白蛋白;TRF:转铁蛋白
βLIP:β脂蛋白;AAT:抗胰蛋白酶;AAG:酸糖蛋白;α2M:α2巨球蛋白
免疫电泳沉淀线的数目和分辨率受许多因素影响。首先是抗原与抗体的比例,同其它沉淀反应一样,要预测抗体与抗原的最适比;其次是抗血清的抗体谱,一只动物的抗血清往往缺乏某些抗体,如将几只动物或几种动物的抗血清混合使用,则效果更好;电泳条件,如缓冲液、琼脂和电泳等皆可直接影响沉淀线的分辨率。对于免疫电泳的分析,更重要的是经验的积累,只有多看,多对比分析,才能作出恰当的结论。
免疫电泳目前大量应用于纯化抗原和抗体成分的分析及正常和异常体液蛋白的识别等方面。
二、对流免疫电泳
对流免疫电泳实质上是定向加速度的免疫双扩散技术,其基本原理是:在琼脂板上打两排孔,左侧各孔加入待测抗原,右侧孔内放入相应抗体,抗原在阴极侧,抗体在阳极侧。通电后,带负电荷的抗原泳向阳极抗体侧,而抗体藉电渗作用流向阴极抗原侧,在两者之间或抗体的另一侧(抗原过量时)形成沉淀线(图12-10).

图12-10对流电泳结果示意图
①Ag为阳性;②Ag为弱阳性;③Ag为强阳性;④Ag为强阳性
IgG作为蛋白质在电泳中比较特殊,4个亚型有不同的表现。G3和G4与一般蛋白无异,泳向阳极;而G1和G2则因其带电荷少,受电渗的作用力大于电泳,所以被水分子携裹向阴极移动。这就形成了IgG的特殊电泳形式:一部分泳向阳极,另一部分泳向阴极,在抗体孔两侧皆有抗体存在。因此,所谓对流只是部分IgG的电渗作用造成。
三、火箭免疫电泳
火箭免疫电泳技术又称作单向电泳扩散免疫沉淀试验,它是由单向扩散发展起来的一项定量技术,实质上是加速度的单向扩散。在含抗体的琼脂板一端打一排抗原孔;加入待测标本后,将抗原置阴极端,用横距2~3mA/cm的电流强度进行电泳。抗原泳向阳极,在抗原抗体比例恰当处发生结合沉淀。随着泳动抗原的减少,沉淀逐渐减少,形成峰状的沉淀区,状似火箭(图12-11)。抗体浓度保持不变,峰的高度与抗原量呈正比,用标本中的抗原含量。

图12-11火箭电泳图
①②③为标本;④⑤⑥为标准抗原
火箭电泳操作时应注意以下几点:
1.所用琼脂可选择无电渗或电渗很小的,否则火箭形状不规则。
2.注意电泳终点时间,如火箭电泳顶部呈不清晰的云雾状或圆形皆提示未达终点。
3.标本数量多时,电泳板应先置电泳槽上,搭桥并开启电源(电流要小)后再加样。否则易形成宽底峰形,使定量不准。
4.作IgG定量时,由于抗原和抗体的性质相同,火箭峰因电渗呈纺缍状。为了纠正这种现象,可用甲醛与IgG上的氨基结合(甲酰化),使本来带两性电荷的IgG变为只带电荷,加快了电泳速度,抵消了电渗作用,而出现伸向阳极的火箭峰。
火箭电泳作为抗原定量只能测定μg/ml以上的含量,如低于此水平则难于形成可见的沉淀峰。加入少量125I标记的标准抗原共同电泳,则可在含抗体的琼脂中形成不可见的放射自显影技术。根据自显影火箭峰降低的程度(竞争法)可计算出抗原的浓度。放射免疫自显影技术可测出ng/ml的抗原浓度。
四、免疫固定电泳
免疫固定电泳(immunofixationelectrophoresis,IFE)是Alper和Johnson(1969)推荐的一项有实用价值的电泳加沉淀反应技术。可用于各种蛋白质的鉴定。该法原理类似免疫电泳,不同之处是将血清直接加于电泳后蛋白质区带表面,或将浸有抗血清的滤纸贴于其上,抗原与对应抗体直接发生沉淀反应,形成的复合物嵌于固相支持物中。将未结合的游离抗原或抗体洗去,则出现被结合固定的某种蛋白。区带电泳支持物选用滤纸、醋纤膜、琼脂或聚丙烯酰胺皆可。
免疫固定电泳最常用于M蛋白的鉴定。方法是:先将患者血清或血浆在醋纤膜上或琼脂上作区带电泳(一般作6条标本),达到预定时间后取下,加抗血清,由上而下依次加抗人全血清、抗IgG、抗IgA、抗IgM、抗κ轻链和抗λ轻链。必要时还可加抗Fab、抗Fc等特殊抗血清。作用30min后洗去游离蛋白质,染色后则可被固定的相应M蛋白成分。
