经典的沉淀试验有4个缺点无法克服,即操作繁琐、敏感度低(10~100μg/ml)、时间长和难以自动化。根据抗原与抗体能在液体内快速结合的原理,70年代出现了微量免疫沉淀测定法,即免疫透射浊度测定、免疫胶乳浊度测定和免疫散射浊度测定法。这3种技术皆已常规用于临床体液蛋白的检测,并已创造出了多种自动化仪器。
免疫浊度测定的基本原理是:抗原抗体在特殊缓冲液中快速形成抗原抗体复合物,使反应液出现浊度。当反应液中保持抗体过量时,形成的复合物随抗原量增加而增加,反应液的浊度亦随之增加,与一系列的标准品对照,即可计算出受检物的含量。
免疫浊度测定法按照仪器设计的不同可以分为两种,即比浊仪测定(turbidimetermeasure)和散射比浊仪测定(nephelomitermeasure)。比浊仪测定是测量由于反射、吸收或散射引起的入射光衰减,其读数以吸光度A表示。A什反映了入射光与透射光的比率(A=2-log10T,T代表浊度百分比)。散射比浊仪测定是测量入射光遇到质点(复合物)后呈一定角度散射的光量,该散射光经放大后以散射值表示。两者的比较见图12-12。
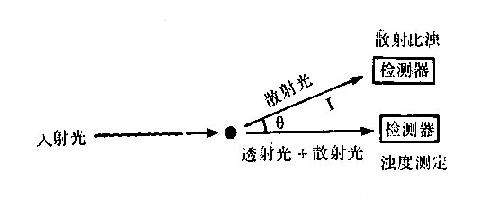
图12-12透射光和散射光测定比较
由于免疫复合物的形成有时限变化,当抗原抗体相遇后立即结合成小复合物(<19S),几分种到几小时才形成可见的复合物(>19S)。作为快速比浊测定,这种速度太慢,加入聚合剂(或促聚剂)可中速大的免疫复合物形成。目前促聚剂多用聚乙二醇(MW6000~8000),浓度约为4%。
浊度测定亦有其弱点。其一是抗原或抗体量大大过剩时易出现可溶性复合物,造成测定误差,测定单克隆蛋白时这种更易出现。其二是应维持反应管中抗体蛋白量始终过剩,这个值要预先测定,使仪器的测定范围在低于生理范围到高于正常范围之间;其三是受血脂的影响,尤其是低稀释度时,脂蛋白的小颗粒可形成浊度,使测定值假性升高。
二、免疫胶乳浊度测定法
在上述比浊法中,少量的小的抗原抗体复合物极难形成浊度,除非放置较长时间;如形成较大的复合物,则抗原和抗体用量也较大,显然不符合微量化的要求。于是发展了免疫胶乳浊度测定,其基本原理是:将抗体吸附在大小适中、均匀一致的胶乳颗粒上,当遇到相应抗原时,则使胶乳颗粒发生凝集。单个胶乳颗粒在入射光波之内不阻碍光线透过,两个或两个以上胶乳颗粒凝聚时则使透过光减少,这种减少的程度与胶乳颗粒凝聚的程度呈正比,当然也与待测抗原量呈正比。见图12-13。
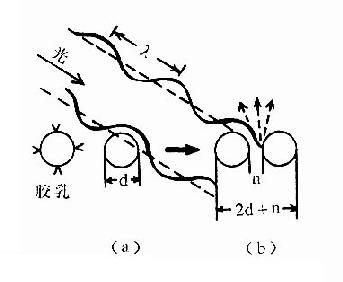
图12-13载体胶乳免疫比浊原理
(a)带抗体的胶乳在波长之内可透过光线;(b)结合后,则形成光线衰减
该技术的关键在于两个方面。首先是选择适用的胶乳,其大小(直径)要稍小于波长。用500nm波长者,选择100nm颗粒较适合;用585nm波长者,则选用100~200nm颗粒为好。目前多用200nm的胶乳颗粒。其次,胶乳与抗体结合时用化学交联虽好,但失活也较严重;一般用吸附法即可。
三、免疫速率散射浊度测定法
速率散射比浊法(ratenephelometry)是Sternberg(1977)创建的。光沿水平轴照射时,碰到小颗粒的免疫复合物可导致光散射,散射光的强度与复合物的含量成正比,亦即待测抗原越多,形成的复合物也越多,散射光就越强。
速率散射比浊测定是一种抗原抗体结合的动态测定法。经典的沉淀反应皆在抗原抗体结合完成后进行复合物的定性或定量测定(终点法);若在抗原抗体反应的最高峰(约在1min内)测定其复合物形成的速率(速率法),则可达到快速、准确的目的。
